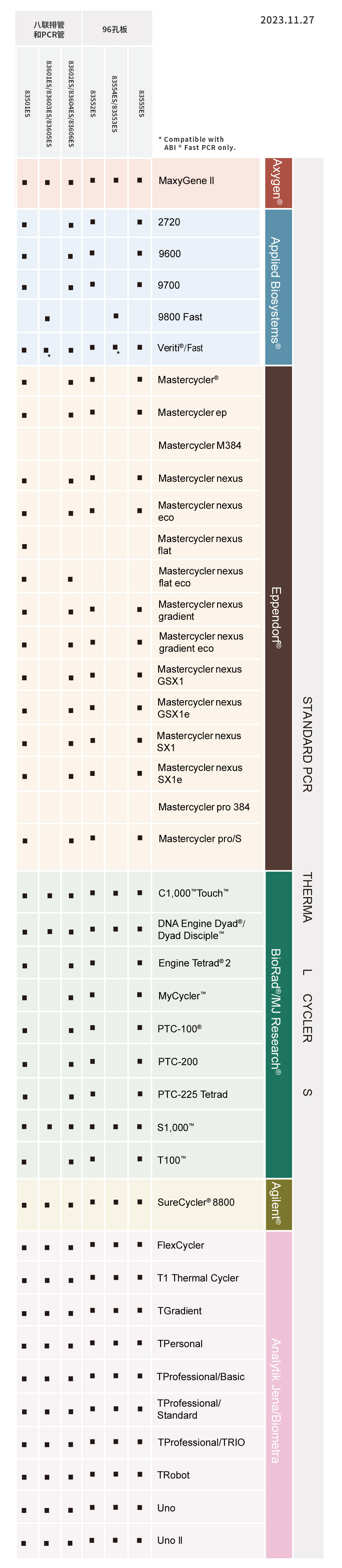
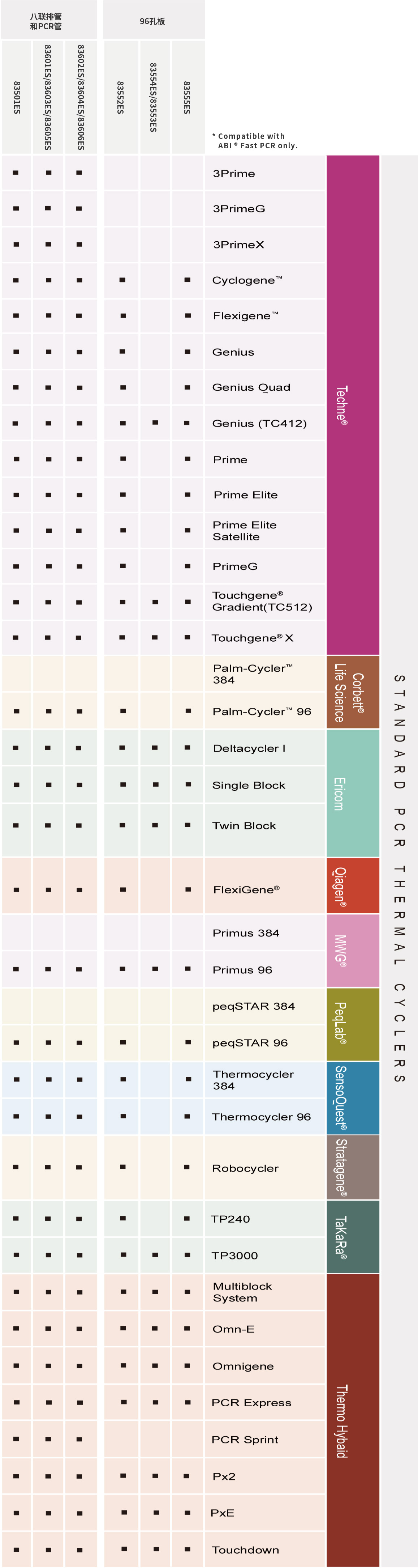
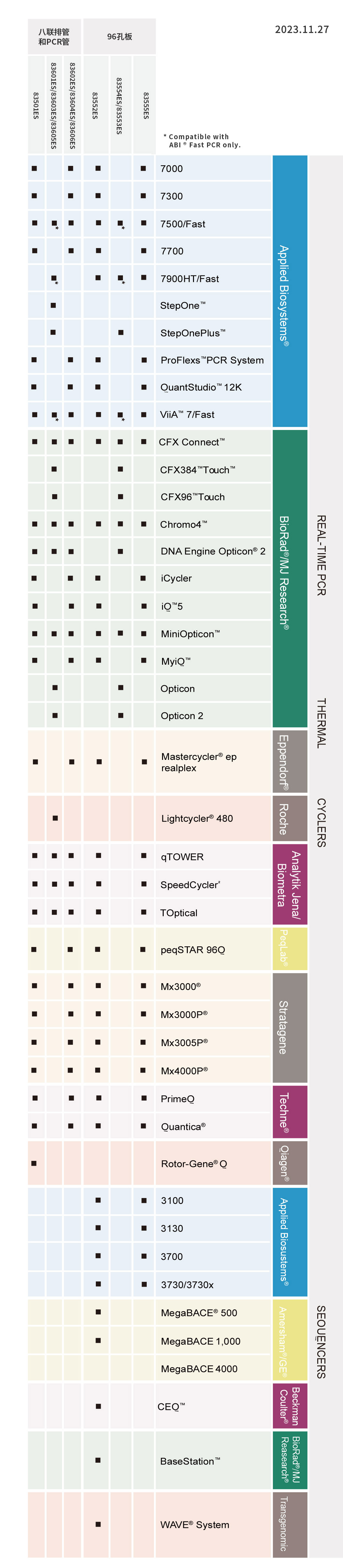
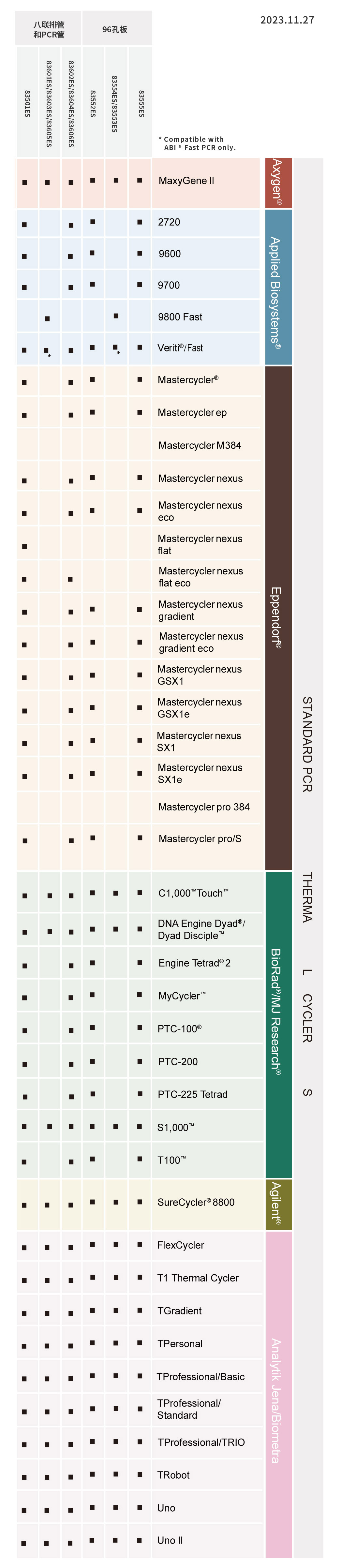
病原体多重PCR预混液(4×Multiplex PCR Master Mix)
产品说明书
FAQ
COA
已发表文献
本产品适用于多重PCR实验。4×Multiplex PCR Master Mix for Pathogen以热启动多重Taq酶制剂与4×扩增缓冲液为组分配置成预混液。本预混液可快速便捷地用于多重PCR反应,扩增子GC含量25-75%范围内可以有效扩增。具备高均一性、高特异性和高灵敏度的特点,同时严控背景菌。本试剂可兼容30~100对以内不同大小片段的多重扩增,也可用于进行数千重及以上扩增子的捕获。可应用病原微生物检测、环境微生物鉴定、食品安全检测等多个应用场景。
运输与保存方式
冰袋运输。-25 ~ -15℃储存,有效期2年。
实验流程
- 推荐反应体系:
一轮反应体系
|
组分 |
体积(μL) |
终浓度 |
|
4×Hieff® Multiplex PCR Master Mix for Pathogen |
7.5 |
1× |
|
Primer mix |
x |
0.02 μM-0.5 μM |
|
模板DNA |
x |
1 ng-400 ng |
|
无菌超纯水 |
x |
– |
|
总体积 |
To30 |
|
【注】
1上表中DNA量和引物浓度均为推荐用量和浓度,可根据具体实验情况进行调整最适浓度。
2)参考建议:每条引物的浓度可在0.02 μM-0.5 μM范围内进行调整。
3)预混液中已经包含扩增所需要的酶、dNTP、盐离子等,无需额外添加。
二轮反应体系
|
组分 |
体积(μL) |
终浓度 |
|
2×Hieff® Multiplex PCR Master Mix for Pathogen(Cat.13581) |
15 |
1× |
|
Primer Index mix |
4(~6 pmol) |
|
|
一轮纯化产物 |
11 |
|
|
无菌超纯水 |
x |
– |
|
总体积 |
To 30 |
|
- 推荐反应程序:
|
循环步骤 |
温度(℃) |
时间 |
循环数 |
|
预变性 |
95℃ |
3 min |
1 |
|
变性 |
95℃ |
30 sec |
X |
|
退火 |
60℃ |
30 sec |
|
|
延伸 |
72℃ |
30 sec |
|
|
终延伸 |
72℃ |
3 min |
|
|
暂存 |
4℃ |
– |
1 |
【注】
- 退火时间可以根据Panel种类不同,进行适当延长,或者是梯度退火,比如64℃ 1 min,60℃ 1 min;
- 延伸时间以最长片段为准。延伸时间太长会导致非特异性扩增增多,可通过缩短延伸时间来提高扩增特异性,延伸时间不少于30 sec。
- 针对模板含量较低的样本,可通过增加循环数提高扩增产出。
- Panel引物重数较多时可增加退火时间,调整梯度退火程序,或者根据已有Panel的合适的PCR反应程序进行测试。
- 循环数推荐:
|
单管引物重数 |
推荐循环数 (10 ng gDNA ) |
退火延伸时间 |
|
|
一轮 |
二轮 |
||
|
10-50 |
10~28 |
18~28 |
30 s~2 min |
|
50-200 |
10~28 |
16~28 |
30 s~2 min |
|
200-800 |
10~28 |
14~28 |
30 s~2 min |
|
800以上 |
10~28 |
12~28 |
30 s~4 min |
【注】
上表是基于10 ng gDNA进行的一轮及二轮循环数的推荐;当投入量大于10 ng,二轮的相应的循环数可以减少;当投入量小于10 ng,一,二轮的相应的循环数要相应的增加。
- 多重扩增引物纯化
一轮 PCR 产物 0.9×磁珠纯化
1) 准备工作:将 Hieff NGS® DNA Selection Beads 磁珠由冰箱中取出,室温平衡至少 30 min。 配制 80%乙醇。
2) 涡旋振荡或充分颠倒磁珠以保证充分混匀。
3) 吸取 27 μL Hieff NGS® DNA Selection Beads(0.9×,Beads:DNA=0.9:1)至一轮 PCR 产物中,室温孵育 5 min。
4) 将 PCR 管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约 5 min),小心移除上清。
5) 保持 PCR 管始终置于磁力架中,加入 200 μL 新鲜配制的 80%乙醇漂洗磁珠,室温孵育 30 sec 后,小心移除上清。
6) 重复步骤 5,总计漂洗两次。
7) 保持 PCR 管始终置于磁力架中,开盖空气干燥磁珠至刚刚出现龟裂(不超过 5min)。
8) 直接加入 11 μL ddH2O,将 PCR 管从磁力架中取出,涡旋振荡或使用移液器轻轻吹打至充分混匀,室温静置 5 min。进入下一步反应。
二轮 PCR 产物 0.9×磁珠纯化
1) 准备工作:将 Hieff NGS® DNA Selection Beads 磁珠由冰箱中取出,室温平衡至少 30 min。 配制 80%乙醇。
2) 涡旋振荡或充分颠倒磁珠以保证充分混匀。
3) 吸取 27 μL Hieff NGS® DNA Selection Beads(0.9×,Beads:DNA=0.9:1)至一轮 PCR 产物中,室温孵育 5 min。
4) 将 PCR 管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约 5 min),小心移除上清。
5) 保持 PCR 管始终置于磁力架中,加入 200 μL 新鲜配制的 80%乙醇漂洗磁珠,室温孵育 30 sec 后,小心移除上清。
6) 重复步骤 5,总计漂洗两次。
7) 磁珠晾干后,将PCR管从磁力架上取下,加入30 μL Nuclease-free ddH2O覆盖磁珠,使用移液器吹打混匀。室温孵育2 min。如果磁珠干燥开裂,适当延长孵育时间。
8)将PCR管短暂离心收集后置于磁力架中,分离磁珠和液体直到溶液澄清(约5 min)。 小心吸取25 μL上清转移至新的EP管中,继续进行下一步反应。
HB230308
本产品适用于多重PCR实验。4×Multiplex PCR Master Mix for Pathogen以热启动多重Taq酶制剂与4×扩增缓冲液为组分配置成预混液。本预混液可快速便捷地用于多重PCR反应,扩增子GC含量25-75%范围内可以有效扩增。具备高均一性、高特异性和高灵敏度的特点,同时严控背景菌。本试剂可兼容30~100对以内不同大小片段的多重扩增,也可用于进行数千重及以上扩增子的捕获。可应用病原微生物检测、环境微生物鉴定、食品安全检测等多个应用场景。
运输与保存方式
冰袋运输。-25 ~ -15℃储存,有效期2年。
实验流程
- 推荐反应体系:
一轮反应体系
|
组分 |
体积(μL) |
终浓度 |
|
4×Hieff® Multiplex PCR Master Mix for Pathogen |
7.5 |
1× |
|
Primer mix |
x |
0.02 μM-0.5 μM |
|
模板DNA |
x |
1 ng-400 ng |
|
无菌超纯水 |
x |
– |
|
总体积 |
To30 |
|
【注】
1上表中DNA量和引物浓度均为推荐用量和浓度,可根据具体实验情况进行调整最适浓度。
2)参考建议:每条引物的浓度可在0.02 μM-0.5 μM范围内进行调整。
3)预混液中已经包含扩增所需要的酶、dNTP、盐离子等,无需额外添加。
二轮反应体系
|
组分 |
体积(μL) |
终浓度 |
|
2×Hieff® Multiplex PCR Master Mix for Pathogen(Cat.13581) |
15 |
1× |
|
Primer Index mix |
4(~6 pmol) |
|
|
一轮纯化产物 |
11 |
|
|
无菌超纯水 |
x |
– |
|
总体积 |
To 30 |
|
- 推荐反应程序:
|
循环步骤 |
温度(℃) |
时间 |
循环数 |
|
预变性 |
95℃ |
3 min |
1 |
|
变性 |
95℃ |
30 sec |
X |
|
退火 |
60℃ |
30 sec |
|
|
延伸 |
72℃ |
30 sec |
|
|
终延伸 |
72℃ |
3 min |
|
|
暂存 |
4℃ |
– |
1 |
【注】
- 退火时间可以根据Panel种类不同,进行适当延长,或者是梯度退火,比如64℃ 1 min,60℃ 1 min;
- 延伸时间以最长片段为准。延伸时间太长会导致非特异性扩增增多,可通过缩短延伸时间来提高扩增特异性,延伸时间不少于30 sec。
- 针对模板含量较低的样本,可通过增加循环数提高扩增产出。
- Panel引物重数较多时可增加退火时间,调整梯度退火程序,或者根据已有Panel的合适的PCR反应程序进行测试。
- 循环数推荐:
|
单管引物重数 |
推荐循环数 (10 ng gDNA ) |
退火延伸时间 |
|
|
一轮 |
二轮 |
||
|
10-50 |
10~28 |
18~28 |
30 s~2 min |
|
50-200 |
10~28 |
16~28 |
30 s~2 min |
|
200-800 |
10~28 |
14~28 |
30 s~2 min |
|
800以上 |
10~28 |
12~28 |
30 s~4 min |
【注】
上表是基于10 ng gDNA进行的一轮及二轮循环数的推荐;当投入量大于10 ng,二轮的相应的循环数可以减少;当投入量小于10 ng,一,二轮的相应的循环数要相应的增加。
- 多重扩增引物纯化
一轮 PCR 产物 0.9×磁珠纯化
1) 准备工作:将 Hieff NGS® DNA Selection Beads 磁珠由冰箱中取出,室温平衡至少 30 min。 配制 80%乙醇。
2) 涡旋振荡或充分颠倒磁珠以保证充分混匀。
3) 吸取 27 μL Hieff NGS® DNA Selection Beads(0.9×,Beads:DNA=0.9:1)至一轮 PCR 产物中,室温孵育 5 min。
4) 将 PCR 管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约 5 min),小心移除上清。
5) 保持 PCR 管始终置于磁力架中,加入 200 μL 新鲜配制的 80%乙醇漂洗磁珠,室温孵育 30 sec 后,小心移除上清。
6) 重复步骤 5,总计漂洗两次。
7) 保持 PCR 管始终置于磁力架中,开盖空气干燥磁珠至刚刚出现龟裂(不超过 5min)。
8) 直接加入 11 μL ddH2O,将 PCR 管从磁力架中取出,涡旋振荡或使用移液器轻轻吹打至充分混匀,室温静置 5 min。进入下一步反应。
二轮 PCR 产物 0.9×磁珠纯化
1) 准备工作:将 Hieff NGS® DNA Selection Beads 磁珠由冰箱中取出,室温平衡至少 30 min。 配制 80%乙醇。
2) 涡旋振荡或充分颠倒磁珠以保证充分混匀。
3) 吸取 27 μL Hieff NGS® DNA Selection Beads(0.9×,Beads:DNA=0.9:1)至一轮 PCR 产物中,室温孵育 5 min。
4) 将 PCR 管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约 5 min),小心移除上清。
5) 保持 PCR 管始终置于磁力架中,加入 200 μL 新鲜配制的 80%乙醇漂洗磁珠,室温孵育 30 sec 后,小心移除上清。
6) 重复步骤 5,总计漂洗两次。
7) 磁珠晾干后,将PCR管从磁力架上取下,加入30 μL Nuclease-free ddH2O覆盖磁珠,使用移液器吹打混匀。室温孵育2 min。如果磁珠干燥开裂,适当延长孵育时间。
8)将PCR管短暂离心收集后置于磁力架中,分离磁珠和液体直到溶液澄清(约5 min)。 小心吸取25 μL上清转移至新的EP管中,继续进行下一步反应。
HB230308

暂无内容

暂无内容