天然腔肠素 腔肠素游离酸|Coelenterazine Native
产品说明书
FAQ
COA
已发表文献
产品描述
天然腔肠素(Coelenterazine native),又称腔肠素游离酸,是海肾荧光素酶(Rluc)和Gaussia荧光素酶(Gluc)等多种荧光素酶的作用底物,也是水母发光蛋白的辅助因子,应用非常广泛,可用于检测活细胞中钙离子浓度,基因报告分析,BRET(生物发光共振能量转移)研究,ELISA,HTS,以及组织或细胞中ROS水平的化学发光检测。
产品性质
|
英文别名(English synonym) |
Renilla luciferin;Coelenterazine free base |
|
CAS号(CAS NO.) |
55779-48-1 |
|
分子式(Formula) |
C26H21N3O3 |
|
分子量(Molecular weight) |
423.46g/mol |
|
外观(Appearance) |
黄色固体 |
|
溶解性(Solubility) |
溶于甲醇和乙醇,不溶于DMSO |
|
纯度(Purity)(TLC) |
>97% |
|
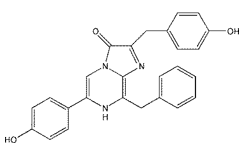
结构(Structure) |
|
运输与保存方法
冰袋运输;粉末-20℃避光干燥保存,最好保存在惰性气体环境下,避免接触空气;长期保存于-70℃。有效期2年。
腔肠素的溶解
对于所有进行荧光信号检测的试验建议溶液现用现配。建议可用乙醇或丙二醇配制成储存液(配制浓度可参考文献推荐)。在使用时需将储存液用合适的缓冲液稀释成工作液。
注意:1)在用蒸馏水或者PBS及其他的溶液进行腔肠素储存液的稀释时需排除稀释液中的气泡。同时工作液最好呈弱酸性,既可以减缓腔肠素的氧化,同时也可防止沉淀的析出。但是弱酸也有可能对后续荧光强度RLU的检测造成误差。
2)腔肠素的工作液不稳定,避免过夜保存。
注意事项
1)保存时若接触空气,时间过久会使得腔肠素氧化,造成实验结果的不准确性。
2)对于储存液的制备,较稳定的是保存于丙二醇中,同时可加入还原剂如L-抗坏血栓,β-巯基乙醇,DTT,DTE(二硫赤糖醇),或少量的盐酸。还原剂的存在可能会破坏荧光素酶的结构,也会影响腔肠素的氧化速率。
3)腔肠素在醇类物质中的冰冻保存可能会导致沉淀的析出(和浓度有关),可通过将溶液加热至50-60℃至其溶解。在使用前请确保眼观无沉淀。
4)最适溶剂的选择取决于多种因素,如还原剂。对于水母发光蛋白的检测,可选用β-巯基乙醇,因为此还原剂能够使水母发光蛋白更好地与腔肠素作用。但对于Gluc蛋白的检测,由于蛋白中含有5对二硫键,在还原剂的存在状态下不能够检测到荧光信号。
5)腔肠素在不同溶剂中的溶解特性:(单位:mg/mL)
|
Solvents |
Room Temp (RT) |
60°C (heat, vortex) |
|
Methanol 100% |
46 |
70 |
|
Ethanol 100% |
64 |
196 |
|
Propanol 100% |
82 |
204 |
|
Butanol 100% |
86 |
180 |
|
Propylene Glycol |
24 |
240 |
|
b-Mercaptoethanol |
160 |
268 |
注:a:腔肠素的丙二醇溶液在室温下的溶解度较低,但是在-70℃的状态下没有沉淀析出。
b:腔肠素在β-巯基乙醇中的溶解度在室温和60℃时都是最高的,但能够稳定存在的时间还有待进一步测试。
6)当使用多孔板进行荧光值的检测时,建议通过设置对照孔来消除由于腔肠素在工作液中不断被氧化所带来的误差。
7)为了您的安全和健康,请穿实验服并戴一次性手套操作。
8) 本产品仅作科研用途!
HB220725
产品描述
天然腔肠素(Coelenterazine native),又称腔肠素游离酸,是海肾荧光素酶(Rluc)和Gaussia荧光素酶(Gluc)等多种荧光素酶的作用底物,也是水母发光蛋白的辅助因子,应用非常广泛,可用于检测活细胞中钙离子浓度,基因报告分析,BRET(生物发光共振能量转移)研究,ELISA,HTS,以及组织或细胞中ROS水平的化学发光检测。
产品性质
|
英文别名(English synonym) |
Renilla luciferin;Coelenterazine free base |
|
CAS号(CAS NO.) |
55779-48-1 |
|
分子式(Formula) |
C26H21N3O3 |
|
分子量(Molecular weight) |
423.46g/mol |
|
外观(Appearance) |
黄色固体 |
|
溶解性(Solubility) |
溶于甲醇和乙醇,不溶于DMSO |
|
纯度(Purity)(TLC) |
>97% |
|
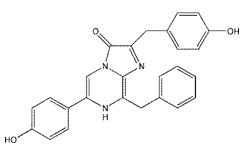
结构(Structure) |
|
运输与保存方法
冰袋运输;粉末-20℃避光干燥保存,最好保存在惰性气体环境下,避免接触空气;长期保存于-70℃。有效期2年。
腔肠素的溶解
对于所有进行荧光信号检测的试验建议溶液现用现配。建议可用乙醇或丙二醇配制成储存液(配制浓度可参考文献推荐)。在使用时需将储存液用合适的缓冲液稀释成工作液。
注意:1)在用蒸馏水或者PBS及其他的溶液进行腔肠素储存液的稀释时需排除稀释液中的气泡。同时工作液最好呈弱酸性,既可以减缓腔肠素的氧化,同时也可防止沉淀的析出。但是弱酸也有可能对后续荧光强度RLU的检测造成误差。
2)腔肠素的工作液不稳定,避免过夜保存。
注意事项
1)保存时若接触空气,时间过久会使得腔肠素氧化,造成实验结果的不准确性。
2)对于储存液的制备,较稳定的是保存于丙二醇中,同时可加入还原剂如L-抗坏血栓,β-巯基乙醇,DTT,DTE(二硫赤糖醇),或少量的盐酸。还原剂的存在可能会破坏荧光素酶的结构,也会影响腔肠素的氧化速率。
3)腔肠素在醇类物质中的冰冻保存可能会导致沉淀的析出(和浓度有关),可通过将溶液加热至50-60℃至其溶解。在使用前请确保眼观无沉淀。
4)最适溶剂的选择取决于多种因素,如还原剂。对于水母发光蛋白的检测,可选用β-巯基乙醇,因为此还原剂能够使水母发光蛋白更好地与腔肠素作用。但对于Gluc蛋白的检测,由于蛋白中含有5对二硫键,在还原剂的存在状态下不能够检测到荧光信号。
5)腔肠素在不同溶剂中的溶解特性:(单位:mg/mL)
|
Solvents |
Room Temp (RT) |
60°C (heat, vortex) |
|
Methanol 100% |
46 |
70 |
|
Ethanol 100% |
64 |
196 |
|
Propanol 100% |
82 |
204 |
|
Butanol 100% |
86 |
180 |
|
Propylene Glycol |
24 |
240 |
|
b-Mercaptoethanol |
160 |
268 |
注:a:腔肠素的丙二醇溶液在室温下的溶解度较低,但是在-70℃的状态下没有沉淀析出。
b:腔肠素在β-巯基乙醇中的溶解度在室温和60℃时都是最高的,但能够稳定存在的时间还有待进一步测试。
6)当使用多孔板进行荧光值的检测时,建议通过设置对照孔来消除由于腔肠素在工作液中不断被氧化所带来的误差。
7)为了您的安全和健康,请穿实验服并戴一次性手套操作。
8) 本产品仅作科研用途!
HB220725
Q:腔肠素作用原理?
A:腔肠素可作为许多荧光素酶的底物,比如海肾荧光素酶(Rluc),Gaussia 分泌型荧光素酶
(Gluc),以及包括水母发光蛋白(aequorin)和薮枝螅发光蛋白(Obelia)在内的光蛋白
(Photoproteins)。其发光原理是:以腔肠素为底物的荧光素酶在有分子氧的条件下,氧化腔肠素,产生高能量的中间产物,并在此过程中发射蓝色光,峰值发射波长约为 450~480 nm。
Q:腔肠素溶液如何配制?
A:腔肠素溶液配制方式来源文献,仅供参考,具体工作浓度建议参考文献做梯度摸索最佳浓度。母液:称取 1mg 腔肠素粉末直接溶解于 197µl 酸化的甲醇溶液( 100% 甲醇中含有20µl/ml 3M 或者 6M HCl),配制成 12 mM (~5mg/ml,5×) 的腔肠素储存液。 工作液:如体外:10 5 次方的细胞数可用 10 μ M 。
[1] Xu P, Huang S, Zhang H, et al. Structural insights into the lipid and ligand regulation of serotonin receptors. Nature. 2021;592(7854):469-473. doi:10.1038/s41586-021-03376-8(IF:49.962)
[2] Stauch B, Johansson LC, McCorvy JD, et al. Structural basis of ligand recognition at the human MT1 melatonin receptor [published correction appears in Nature. 2019 May 3;:]. Nature. 2019;569(7755):284-288. doi:10.1038/s41586-019-1141-3(IF:43.070)
[3] Xu P, Huang S, Mao C, et al. Structures of the human dopamine D3 receptor-Gi complexes. Mol Cell. 2021;81(6):1147-1159.e4. doi:10.1016/j.molcel.2021.01.003(IF:17.970)
[4] Tan Y, Xu P, Huang S, et al. Structural insights into the ligand binding and Gi coupling of serotonin receptor 5-HT5A. Cell Discov. 2022;8(1):50. Published 2022 May 24. doi:10.1038/s41421-022-00412-3(IF:10.849)
[5] Ji M, Wang X, Zheng H, et al. A Secreted Reporter for Blood Monitoring of Pyroptotic Cell Death [published correction appears in Anal Chem. 2021 Mar 2;93(8):4142]. Anal Chem. 2020;92(23):15565-15572. doi:10.1021/acs.analchem.0c03629(IF:6.785)
[6] Zheng H, Chen S, Wang X, Xie J, Tian J, Wang F. Intron Retained Bioluminescence Reporter for Real-Time Imaging of Pre-mRNA Splicing in Living Subjects. Anal Chem. 2019;91(19):12392-12398. doi:10.1021/acs.analchem.9b02935(IF:6.350)
[7] Guo B, Shi X, Ma Z, Ji M, Tang C, Wang F. A ratiometric dual luciferase reporter for quantitative monitoring of pre-mRNA splicing efficiency in vivo. J Biol Chem. 2021;297(2):100933. doi:10.1016/j.jbc.2021.100933(IF:5.157)
[8] Hu F, Zhang Y, Liu Q, Wang Z. PurA facilitates Edwardsiella piscicida to escape NF-κB signaling activation. Fish Shellfish Immunol. 2022;124:254-260. doi:10.1016/j.fsi.2022.04.001(IF:4.581)
[9] Xie J, Zheng H, Chen S, Shi X, Mao W, Wang F. Rational Design of an Activatable Reporter for Quantitative Imaging of RNA Aberrant Splicing In Vivo. Mol Ther Methods Clin Dev. 2020;17:904-911. Published 2020 Apr 18. doi:10.1016/j.omtm.2020.04.007(IF:4.533)
[10] Zheng H, Wang X, Chen S, et al. Real-Time Functional Bioimaging of Neuron-Specific MicroRNA Dynamics during Neuronal Differentiation Using a Dual Luciferase Reporter. ACS Chem Neurosci. 2019;10(3):1696-1705. doi:10.1021/acschemneuro.8b00614(IF:4.211)