产品描述
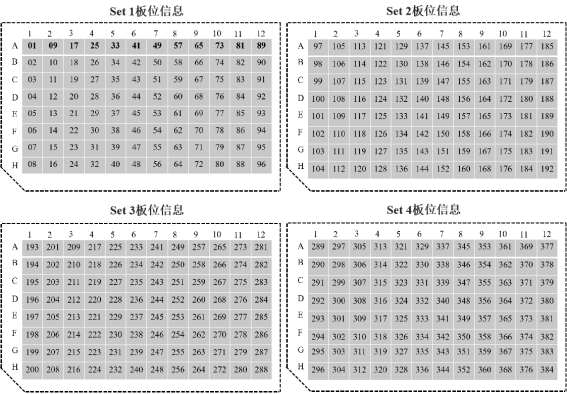
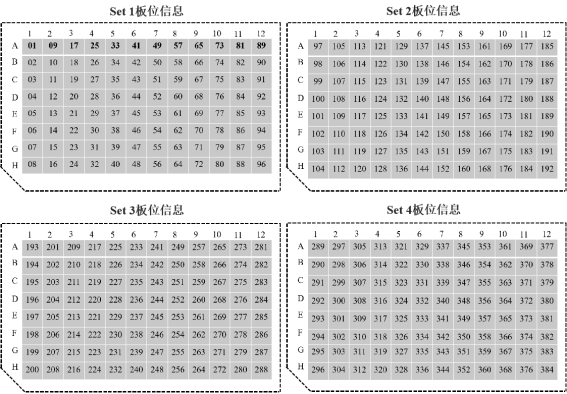
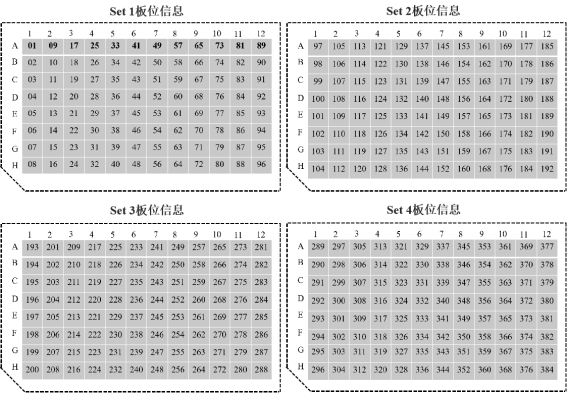
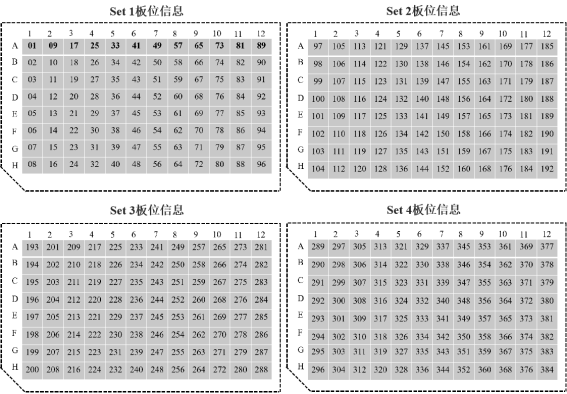
Hieff NGS® Complete Adapter Kit for Illumina®是针对Illumina®高通量文库构建专用配套试剂盒,共分为4个Set,每个Set中包含12种不同的Barcode接头,适用于Illumina®高通量测序平台多样品DNA文库构建。试剂盒中提供的所有试剂都经过严格的质量控制和功能验证,最大程度保证了文库构建的稳定性和可重复性。
产品组分
|
编号
|
组分
|
产品规格
|
|
12×4 T
|
12×16 T
|
|
12615
|
DNA Adapter 1-12
|
14 μL each
|
56 μL each
|
|
12616
|
DNA Adapter 13-24
|
14 μL each
|
56 μL each
|
|
12617
|
DNA Adapter 25-36
|
14 μL each
|
56 μL each
|
|
12618
|
DNA Adapter 37-48
|
14 μL each
|
56 μL each
|
运输和保存方法
冰袋运输,-20℃保存,有效期18个月。
注意事项
1)本试剂盒中DNA Adapter的浓度统一为15 μM,单个文库构建的接头使用量根据所用试剂盒进行调整。
2)切勿加热接头,应在室温让其缓慢溶解,实验室温度最好设置为20-25℃。接头避免反复冻融,可短暂存放于4℃。
3)小规格试剂盒(12×4 T)每种组分的DNA Adapter包装量足够进行4个DNA文库构建,共计足够进行48个DNA文库构建,大规格试剂盒(12×16 T)每种组分的DNA Adapter包装量足够进行16个DNA文库构建,共计足够进行192个DNA文库构建。
4)使用Hieff NGS® Complete Adapter Kit for Illumina®试剂盒构建的DNA文库结构如下:
5’ – Universal Adapter – Insert DNA Sequence – DNA Barcode Adapter- 3’
5)试剂盒中提供的每种DNA Adapter中都包含Universal Adapter,且提供一种Barcode序列标签,用于高通量测序时区分样品。
6)为了您的安全和健康,请穿实验服并戴一次性手套操作。
7)本产品仅用作科研用途!
使用方法
DNA Adapter的序列如下:
Universal Adapter:5’-AATGATACGGCGACCACCGAGATCTACACTCTTTCCCTACACGACGCTCTTCCGATCT-3’
Barcode Adapter:5’-GATCGGAAGAGCACACGTCTGAACTCCAGTCACXXXXXX1ATCTCGTATGCCGTCTTCTGCTTG-3’
1XXXXXX表示接头的Barcode区域,其在每个接头中的序列见下表。测序前在Sample Sheet中只需输入这个Barcode序列(6 bp)即可。
|
名称
|
序列
|
|
名称
|
序列
|
|
DNA Adapter 1
|
CGATGT
|
|
DNA Adapter 25
|
ACTGAT
|
|
DNA Adapter 2
|
TGACCA
|
|
DNA Adapter 26
|
ATGAGC
|
|
DNA Adapter 3
|
ACAGTG
|
|
DNA Adapter 27
|
ATTCCT
|
|
DNA Adapter 4
|
GCCAAT
|
|
DNA Adapter 28
|
CAAAAG
|
|
DNA Adapter 5
|
CAGATC
|
|
DNA Adapter 29
|
CAACTA
|
|
DNA Adapter 6
|
CTTGTA
|
|
DNA Adapter 30
|
CACCGG
|
|
DNA Adapter 7
|
ATCACG
|
|
DNA Adapter 31
|
CACGAT
|
|
DNA Adapter 8
|
TTAGGC
|
|
DNA Adapter 32
|
CACTCA
|
|
DNA Adapter 9
|
ACTTGA
|
|
DNA Adapter 33
|
CAGGCG
|
|
DNA Adapter 10
|
GATCAG
|
|
DNA Adapter 34
|
CATGGC
|
|
DNA Adapter 11
|
TAGCTT
|
|
DNA Adapter 35
|
CATTTT
|
|
DNA Adapter 12
|
GGCTAC
|
|
DNA Adapter 36
|
CCAACA
|
|
DNA Adapter 13
|
AGTCAA
|
|
DNA Adapter 37
|
CGGAAT
|
|
DNA Adapter 14
|
AGTTCC
|
|
DNA Adapter 38
|
CTAGCT
|
|
DNA Adapter 15
|
ATGTCA
|
|
DNA Adapter 39
|
CTATAC
|
|
DNA Adapter 16
|
CCGTCC
|
|
DNA Adapter 40
|
CTCAGA
|
|
DNA Adapter 17
|
GTAGAG
|
|
DNA Adapter 41
|
GCGCTA
|
|
DNA Adapter 18
|
GTCCGC
|
|
DNA Adapter 42
|
TAATCG
|
|
DNA Adapter 19
|
GTGAAA
|
|
DNA Adapter 43
|
TACAGC
|
|
DNA Adapter 20
|
GTGGCC
|
|
DNA Adapter 44
|
TATAAT
|
|
DNA Adapter 21
|
GTTTCG
|
|
DNA Adapter 45
|
TCATTC
|
|
DNA Adapter 22
|
CGTACG
|
|
DNA Adapter 46
|
TCCCGA
|
|
DNA Adapter 23
|
GAGTGG
|
|
DNA Adapter 47
|
TCGAAG
|
|
DNA Adapter 24
|
GGTAGC
|
|
DNA Adapter 48
|
TCGGCA
|
推荐Barcode组合:
2个样本:可使用(4, 6)、或(3, 19)。
3个样本:可使用(4, 6, 其他任意1个barcode)、或(3, 19, 其他任意1个barcode)、或(1, 5, 19)、或(3, 12, 15)等。
4个样本:可使用(4, 6, 其他任意2个barcode)、或(3, 19, 其他任意2个barcode)、或(3, 4, 6, 19)、或(1, 2, 5, 16)等。