D-荧光素钾盐(D-Luciferin,Potassium Salt) D-虫荧光素钾盐
产品说明书
FAQ
COA
已发表文献
产品信息
|
产品名称 |
产品编号 |
规格 |
价格(元) |
|
D-Luciferin, Potassium Salt D-荧光素钾盐 |
40902ES01 |
100 mg |
1000.00 |
|
40902ES02 |
500 mg |
2600.00 |
|
|
40902ES03 |
1 g |
3996.00 |
|
|
40902ES08 |
5×1 g |
14898.00 |
|
|
40902ES09 |
5 g |
14898.00 |
产品简介
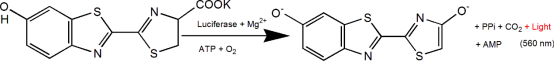
D-荧光素(D-Luciferin)是荧光素酶(Luciferase)的常用底物,普遍应用于整个生物技术领域,特别是体内活体成像技术。其作用机制是在ATP和荧光素酶的作用下,荧光素(底物)能够被氧化发光。当荧光素过量时,产生的光量子数与荧光素酶的浓度呈正相关性(见下图)。将携带荧光素酶编码基因(Luc)的质粒转染入细胞后,导入研究动物如大、小鼠体内,之后注入荧光素,通过生物发光成像技术(BLI)来检测光强度变化,从而实时监测疾病发展状态或药物的治疗功效等。也可以利用ATP对此反应体系的影响,根据生物发光强度的变化来指示能量或生命体征。![]()

D-荧光素也常用于体外研究,包括荧光素酶和ATP水平分析;报告基因分析;高通量测序和各种污染检测。目前有三种产品形式:D-荧光素(游离酸),D-荧光素盐(钠盐和钾盐)。主要差别在于溶解特性:前者的水溶性以及缓冲体系的溶解性都较弱,除非溶于弱碱如低浓度NaOH和KOH溶液。可溶于甲醇和DMSO;后者能够易溶于水或缓冲液中,使用方便,溶剂无毒性,特别适合体内实验。配成溶液后的这三种产品,在绝大多数的应用上都没有实质性的差别。
产品信息
|
货号 |
40902ES01 / 40902ES02 / 40902ES03 / 40902ES08 / 40902ES09 |
|
规格 |
100 mg / 500 mg / 1 g / 5×1 g / 5g |
|
中文名称 |
D-荧光素钾盐 |
|
英文别名称 |
(S)-4,5-Dihydro-2-(6-hydroxy-2-benzothiazolyl)-4-thiazolecarboxylic acid potassium salt; D-Luciferin firefly, potassium salt |
|
CAS号 |
115144-35-9 |
|
分子式 |
C11H7N2O3S2 K |
|
分子量 |
318.42 g/mol |
|
外观 |
淡黄色粉末 |
|
溶解性 |
易溶于水(60 mg/mL) |
|
纯度(HPLC) |
≥99% |
组分信息
|
组分名称 |
40902ES01 |
40902ES02 |
40902ES03 |
40902ES08 |
40902ES09 |
|
D-Luciferin, Potassium Salt D-荧光素钾盐 |
100 mg |
500 mg |
1 g |
5×1 g |
5g |
储存条件
-25~-15℃干燥避光储存,有效期1年。
使用说明
1. 体外生物发光检测
1)用无菌蒸馏水溶解D-荧光素钾盐,配制成30 mg/mL的储存液 (100-200×) ,混匀。立即使用,或分装于-20℃避光保存,避免反复冻融。
2)用预热好的组织培养基将储存液稀释至0.15-0.3 mg/mL的工作液浓度。
3)去除细胞培养基。
4)待图像分析前,向细胞内添加荧光素工作液,37℃孵育5-10 min,然后进行图像分析。
2. 活体成像分析
1)用无菌的DPBS (w/o Mg2+、Ca2+) 配制15 mg/mL的荧光素的储存液,混匀。
2)用0.2 µm滤膜过滤除菌。立即使用,或分装于-20℃避光保存,避免反复冻融。
3)腹腔注射(i.p.),按照150 mg/kg的荧光素/体重浓度进行注射。
4)注射入体内10-15 min(待光信号达到最强稳定平台期)后进行成像分析。
注:建议对每只动物模型都需要建立荧光素酶动力学曲线,从而确定最高信号检测时间和信号平台期。
注意事项
1. 本品(firefly luciferin)和甲虫荧光素(beetle luciferin)仅仅是不同公司在命名上的差异,都是指化合物(S)-2-(6-Hydroxy-2-benzothiazolyl)-2-thiazoline-4-carboxylic acid。
2. 注射方式、动物类型以及体重等都会影响信号的发射,因此建议每次实验都要做荧光素酶动力学曲线,确定最佳信号平台期和最佳的检测时间。
3. 如果要进行ATP的检测,尽量避免外源ATP的污染,如操作时戴手套并使用ATP-free的实验耗材,在进行荧光素的溶解时应使用ATP-free无菌水。
4. 本品要进行避光操作和保存。储存液过滤除菌后可分装于-20℃或-80℃冻存。如果有条件,可对储存液充入氮气或氩气(防止氧化),稳定性和保存时间长达1年。
5. 在进行D-荧光素钾盐的溶解时,应使用无钙镁离子的DPBS,因钙镁离子可能会抑制荧光素酶的活性,此外镁离子可能会对荧光素的氧化造成影响,从而影响检测。
6. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
7. 本产品仅作科研用途!
Ver.CN20231103
产品信息
|
产品名称 |
产品编号 |
规格 |
价格(元) |
|
D-Luciferin, Potassium Salt D-荧光素钾盐 |
40902ES01 |
100 mg |
1000.00 |
|
40902ES02 |
500 mg |
2600.00 |
|
|
40902ES03 |
1 g |
3996.00 |
|
|
40902ES08 |
5×1 g |
14898.00 |
|
|
40902ES09 |
5 g |
14898.00 |
产品简介
D-荧光素(D-Luciferin)是荧光素酶(Luciferase)的常用底物,普遍应用于整个生物技术领域,特别是体内活体成像技术。其作用机制是在ATP和荧光素酶的作用下,荧光素(底物)能够被氧化发光。当荧光素过量时,产生的光量子数与荧光素酶的浓度呈正相关性(见下图)。将携带荧光素酶编码基因(Luc)的质粒转染入细胞后,导入研究动物如大、小鼠体内,之后注入荧光素,通过生物发光成像技术(BLI)来检测光强度变化,从而实时监测疾病发展状态或药物的治疗功效等。也可以利用ATP对此反应体系的影响,根据生物发光强度的变化来指示能量或生命体征。![]()
D-荧光素也常用于体外研究,包括荧光素酶和ATP水平分析;报告基因分析;高通量测序和各种污染检测。目前有三种产品形式:D-荧光素(游离酸),D-荧光素盐(钠盐和钾盐)。主要差别在于溶解特性:前者的水溶性以及缓冲体系的溶解性都较弱,除非溶于弱碱如低浓度NaOH和KOH溶液。可溶于甲醇和DMSO;后者能够易溶于水或缓冲液中,使用方便,溶剂无毒性,特别适合体内实验。配成溶液后的这三种产品,在绝大多数的应用上都没有实质性的差别。
产品信息
|
货号 |
40902ES01 / 40902ES02 / 40902ES03 / 40902ES08 / 40902ES09 |
|
规格 |
100 mg / 500 mg / 1 g / 5×1 g / 5g |
|
中文名称 |
D-荧光素钾盐 |
|
英文别名称 |
(S)-4,5-Dihydro-2-(6-hydroxy-2-benzothiazolyl)-4-thiazolecarboxylic acid potassium salt; D-Luciferin firefly, potassium salt |
|
CAS号 |
115144-35-9 |
|
分子式 |
C11H7N2O3S2 K |
|
分子量 |
318.42 g/mol |
|
外观 |
淡黄色粉末 |
|
溶解性 |
易溶于水(60 mg/mL) |
|
纯度(HPLC) |
≥99% |
组分信息
|
组分名称 |
40902ES01 |
40902ES02 |
40902ES03 |
40902ES08 |
40902ES09 |
|
D-Luciferin, Potassium Salt D-荧光素钾盐 |
100 mg |
500 mg |
1 g |
5×1 g |
5g |
储存条件
-25~-15℃干燥避光储存,有效期1年。
使用说明
1. 体外生物发光检测
1)用无菌蒸馏水溶解D-荧光素钾盐,配制成30 mg/mL的储存液 (100-200×) ,混匀。立即使用,或分装于-20℃避光保存,避免反复冻融。
2)用预热好的组织培养基将储存液稀释至0.15-0.3 mg/mL的工作液浓度。
3)去除细胞培养基。
4)待图像分析前,向细胞内添加荧光素工作液,37℃孵育5-10 min,然后进行图像分析。
2. 活体成像分析
1)用无菌的DPBS (w/o Mg2+、Ca2+) 配制15 mg/mL的荧光素的储存液,混匀。
2)用0.2 µm滤膜过滤除菌。立即使用,或分装于-20℃避光保存,避免反复冻融。
3)腹腔注射(i.p.),按照150 mg/kg的荧光素/体重浓度进行注射。
4)注射入体内10-15 min(待光信号达到最强稳定平台期)后进行成像分析。
注:建议对每只动物模型都需要建立荧光素酶动力学曲线,从而确定最高信号检测时间和信号平台期。
注意事项
1. 本品(firefly luciferin)和甲虫荧光素(beetle luciferin)仅仅是不同公司在命名上的差异,都是指化合物(S)-2-(6-Hydroxy-2-benzothiazolyl)-2-thiazoline-4-carboxylic acid。
2. 注射方式、动物类型以及体重等都会影响信号的发射,因此建议每次实验都要做荧光素酶动力学曲线,确定最佳信号平台期和最佳的检测时间。
3. 如果要进行ATP的检测,尽量避免外源ATP的污染,如操作时戴手套并使用ATP-free的实验耗材,在进行荧光素的溶解时应使用ATP-free无菌水。
4. 本品要进行避光操作和保存。储存液过滤除菌后可分装于-20℃或-80℃冻存。如果有条件,可对储存液充入氮气或氩气(防止氧化),稳定性和保存时间长达1年。
5. 在进行D-荧光素钾盐的溶解时,应使用无钙镁离子的DPBS,因钙镁离子可能会抑制荧光素酶的活性,此外镁离子可能会对荧光素的氧化造成影响,从而影响检测。
6. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
7. 本产品仅作科研用途!
Ver.CN20231103
Q:荧光虫荧光素( Firefly Luciferin)、甲虫荧光素( Beetle Luciferin)和 D-Luciferin 有区别吗?
A:无区别。三者仅仅是不同公司在命名上的差异,均是化合物 (S)-2-(6-Hydroxy-2-benzothiazolyl)-2
-thiazoline-4-carboxylic acid
Q:该系列产品主要用于哪些应用?
A:除用于活体成像外,荧光素类产品还用于荧光素酶参与的其他应用中,如 体外报告基因检测、微生物/病毒监测、焦磷酸测序等
Q:荧光素钠颜料和 D-荧光素钠盐的区别?
A:荧光素钠颜料:可用于细胞通透性检测,通过检测 OD490 处吸光度值测定 颜料的通透性。 D-荧光素钠盐:用于活体成像和报告基因系统,通过冷发光模块检测,不 需要激发光激发。
Q:荧光素钾盐、钠盐、自由酸区别?
A:三者的区别主要在于: 1)溶解性:盐形式易溶于水,其中钾盐溶解度为 60mg/ml,钠盐溶解度为 100mg/ml。自由酸不易溶于水,可用碳酸氢钠溶液弱碱调节溶解,其 在甲醇中的溶解度为10mg/ml,DMSO 中溶解度为 50mg/ml。 2)毒性方面:盐形式在使用过程中较方便,尤其是在体内成像实验中, 因其能够溶解在水中,反应毒性也会更小些(荧光素是一种由苯丙噻唑和 噻唑羧酸基团组成的低分子量有机化合物,有低毒性)。3)使用效果:无明显差异。在体内实验研究中,选用钾盐使用率较高。
Q:荧光素的纯度对实验有成影响吗?
A:有影响。99%以上的纯度较好。对于 99%纯度的荧光素,有 1%的固体杂质。若是这 1 g 的杂质溶 解在 25ml 的缓冲液中(该稀释比例是进行活体成像实验的标准稀释方法),此时杂质的浓度为 0.4 g/L。假 设杂质的分子量为 1000 g/mol,那么杂质的物质的量浓度为 400 μM,该浓度可能会抑制细胞内某些酶的作 用,并且有可能降低实验效果或对动物产生伤害。
Q:产品稳定性如何?
A:粉末避光保存于-20 或-70℃,有效期至少 1 年。
Q:活体成像底物作用原理?
A:D-荧光素(D-Luciferin)是荧光素酶(Luciferase)的常用底物。其作用 机制是在 ATP 和荧光素酶的作用下,荧光素(底物)能够被氧化发光。当 荧光素过量时,产生的光量子数与荧光素酶的浓度呈正相关性。2、天然腔肠素(Coelenterazine native)是海肾荧光素酶(Rluc)和 Gaussia 荧光素酶(Gluc)等多种荧光素酶的作用底物。
Q:推荐仪器?多功能酶标仪能用吗?
A:推荐仪器:1、具有生物化学发光检测模块。荧光素产生的光可以被光度计或闪烁计数器检测。常见的活体成像仪器:如 IVIS® Lumina 小动物活体成像系统,德国 Bruker 公司的 In-Vivo Xtreme 多模式小动物活体成像仪。2、多功能酶标仪:需要和仪器厂家确认是否具体生物化学发光检测模块(注: 不能用荧光显微镜。)
Q:荧光素是能进入细胞膜吗?
A:荧光素是小分子,水溶性和脂溶性都非常好,很容易穿透细胞膜和血脑屏障
Q:尾静脉注射和腹腔注射哪个好?
A:都可以的。腹腔注射扩散较慢,持续发光长;静脉注射,扩散快,但发光持续时间很短。
Q:100mg可以注射几只小鼠?
A:腹腔注射(i.p.),按照150 mg/kg的荧光素/体重浓度进行注射,20g的C57小鼠为例,每只小鼠检测一次的用量:150 mg/kg×20g=3mg,100mg÷3mg=33只。仅供参考,具体的用量以试剂为准,未加损耗情况。
Q:D-荧光素钾盐,对动物有毒副作用吗?
A:一般情况下,D-荧光素钠盐不会对动物产生毒副作用。
Q:荧光素钾盐,分解率是多少?
A:没有该信息。
Q:底物的激发波长和发射波长?
A:化学发光,无需激发波长。萤火虫荧光素检测波长是 560nm。海肾荧光素 检测波长是 465 nm。
Q:底物可以进入活细胞中吗?
A:可以通过血脑屏障,胎盘屏障和血液测试屏障,也可以进入活细胞。
Q:荧光素类注射方式和用量?
A:下面建议浓度来源于文献:1)注射方式:可通过腹腔注射或尾静脉注射 2)注射量:科学的方法是根据动力学曲线评估注射剂量。建立最初尝试注射剂量 为:150mg 底物/kg 小鼠体重。因此,购买量可按照上述方法计算:若 10 只小鼠,22 -25g,则需要底物 33 –37.5mg 。
Q:荧光素的发光特性如何?
A:荧光素腹腔注射老鼠后约 3 min 后,能够表达荧光素酶的细胞开始发光,10 min 后强度达到稳定的最高点,在最高点持续约 10 – 15 min 后开始衰减,可在注射后 10 -15 min 内检测。仅供参考,建议预实验建立荧光素酶 动力学曲线,从而确定最高信号检测时间和信号平台期
Q:活体成像实验,无效果的原因?
A:成功进行活体成像实验需要以下条件:目的组织或细胞表达荧光素酶基因;荧光素底物注射成功; 依赖于发光部位的组织厚度。若实验不成功,可从上述因素查找,荧光素酶基因是否表达,荧光素底物是否未正确注射,及发光部位较深等
Q:荧光素钾(钠)盐溶液如何配制?必须用不含钙离子和镁离 子的 DPBS 溶解吗?
A:1、下面建议浓度来源于文献:
1)储备液(体外实验用) 浓度 100mM,约相当于 30mg/mL。用无菌蒸馏水溶解。 建议:现配现用,若无条件,可分装保存。 长期保存可能会导致信号衰 减。
2)1×工作液(体外实验用) 浓度 0.5mM,约相当于 150ug/mL。用预热的培养基稀释储存液至 1×。建议:现配现用,若多余,则舍弃。不建议再次使用。
3)15mg/mL 储存液(动物实验用)不含钙离子和镁离子的 DPBS 溶解(因为一方面,钙镁离子通常对胰酶活 性有影响;另外一方面在活体成像实验时,Mg2+是催化荧光素底物氧化的 重要因素,而Ca2+是和腔肠素底物氧化有关的离子),混匀。0.22μM 滤器 过滤除菌。 建议:现配现用,长期保存可能会导致信号衰减。
2、除了 DPBS 外,还可以用其他缓冲液溶解荧光素底物,如生理盐水 Nacl 等。原则上避免溶液中的阳离子对实验造成影响。可参考相关文献操作。
[1] Gu Y, Wang Y, He L, et al. Circular RNA circIPO11 drives self-renewal of liver cancer initiating cells via Hedgehog signaling. Mol Cancer. 2021;20(1):132. Published 2021 Oct 14. doi:10.1186/s12943-021-01435-2(IF:27.401)
[2] Huang K, Liang Q, Zhou Y, et al. A Novel Allosteric Inhibitor of Phosphoglycerate Mutase 1 Suppresses Growth and Metastasis of Non-Small-Cell Lung Cancer [published correction appears in Cell Metab. 2021 Jan 5;33(1):223]. Cell Metab. 2019;30(6):1107-1119.e8. doi:10.1016/j.cmet.2019.09.014(IF:22.415)
[3] Dong X, Cheng R, Zhu S, et al. A Heterojunction Structured WO2.9-WSe2 Nanoradiosensitizer Increases Local Tumor Ablation and Checkpoint Blockade Immunotherapy upon Low Radiation Dose. ACS Nano. 2020;14(5):5400-5416. doi:10.1021/acsnano.9b08962(IF:14.588)
[4] Zheng DW, Gao F, Cheng Q, et al. A vaccine-based nanosystem for initiating innate immunity and improving tumor immunotherapy. Nat Commun. 2020;11(1):1985. Published 2020 Apr 24. doi:10.1038/s41467-020-15927-0(IF:12.121)
[5] Hu J, Su H, Cao H, et al. AUXIN RESPONSE FACTOR7 integrates gibberellin and auxin signaling via interactions between DELLA and AUX/IAA proteins to regulate cambial activity in poplar. Plant Cell. 2022;34(7):2688-2707. doi:10.1093/plcell/koac107(IF:11.277)
[6] Qi P, Huang M, Hu X, et al. A Ralstonia solanacearum effector targets TGA transcription factors to subvert salicylic acid signaling. Plant Cell. 2022;34(5):1666-1683. doi:10.1093/plcell/koac015(IF:11.277)
[7] Huang X, Qiu M, Wang T, et al. Carrier-free multifunctional nanomedicine for intraperitoneal disseminated ovarian cancer therapy. J Nanobiotechnology. 2022;20(1):93. Published 2022 Feb 22. doi:10.1186/s12951-022-01300-4(IF:10.435)
[8] Tang Y, Lin S, Yin S, et al. In situ gas foaming based on magnesium particle degradation: A novel approach to fabricate injectable macroporous hydrogels. Biomaterials. 2020;232:119727. doi:10.1016/j.biomaterials.2019.119727(IF:10.273)
[9] Zhang X, Zheng S, Hu C, et al. Cancer-associated fibroblast-induced lncRNA UPK1A-AS1 confers platinum resistance in pancreatic cancer via efficient double-strand break repair. Oncogene. 2022;41(16):2372-2389. doi:10.1038/s41388-022-02253-6(IF:9.867)
[10] Qiao K, Liu Y, Xu Z, et al. RNA m6A methylation promotes the formation of vasculogenic mimicry in hepatocellular carcinoma via Hippo pathway. Angiogenesis. 2021;24(1):83-96. doi:10.1007/s10456-020-09744-8(IF:9.780)
[11] Wu Q, Kuang K, Lyu M, et al. Allosteric deactivation of PIFs and EIN3 by microproteins in light control of plant development. Proc Natl Acad Sci U S A. 2020;117(31):18858-18868. doi:10.1073/pnas.2002313117(IF:9.412)
[12] Meng DF, Sun R, Liu GY, et al. S100A14 suppresses metastasis of nasopharyngeal carcinoma by inhibition of NF-kB signaling through degradation of IRAK1. Oncogene. 2020;39(30):5307-5322. doi:10.1038/s41388-020-1363-8(IF:7.971)
[13] Gao Y, Wang J, Han H, et al. A nanoparticle-containing polycaprolactone implant for combating post-resection breast cancer recurrence. Nanoscale. 2021;13(34):14417-14425. Published 2021 Sep 2. doi:10.1039/d1nr04125h(IF:7.790)
[14] Jiang W, Li T, Guo J, et al. Bispecific c-Met/PD-L1 CAR-T Cells Have Enhanced Therapeutic Effects on Hepatocellular Carcinoma. Front Oncol. 2021;11:546586. Published 2021 Mar 10. doi:10.3389/fonc.2021.546586(IF:6.244)
[15] Zhou Y , Zhou C , Zou Y , et al. Multi pH-sensitive polymer-drug conjugate mixed micelles for efficient co-delivery of doxorubicin and curcumin to synergistically suppress tumor metastasis. Biomater Sci. 2020;8(18):5029-5046. doi:10.1039/d0bm00840k(IF:6.183)
[16] Zhao X, Liu X, Zhang P, et al. Injectable peptide hydrogel as intraperitoneal triptolide depot for the treatment of orthotopic hepatocellular carcinoma. Acta Pharm Sin B. 2019;9(5):1050-1060. doi:10.1016/j.apsb.2019.06.001(IF:5.808)
[17] Li M, Wang J, Yu Y, et al. Characterization of Mesenchymal Stem Cells Derived from Bisphosphonate-Related Osteonecrosis of the Jaw Patients' Gingiva. Stem Cell Rev Rep. 2022;18(1):378-394. doi:10.1007/s12015-021-10241-8(IF:5.739)
[18] Zhang X, Li Y, Ji J, et al. Gadd45g initiates embryonic stem cell differentiation and inhibits breast cell carcinogenesis. Cell Death Discov. 2021;7(1):271. Published 2021 Oct 2. doi:10.1038/s41420-021-00667-x(IF:5.241)
[19] Wu D, Lv J, Zhao R, et al. PSCA is a target of chimeric antigen receptor T cells in gastric cancer. Biomark Res. 2020;8:3. Published 2020 Jan 28. doi:10.1186/s40364-020-0183-x(IF:4.866)
[20] Qiao K, Chen C, Liu H, Qin Y, Liu H. Pinin Induces Epithelial-to-Mesenchymal Transition in Hepatocellular Carcinoma by Regulating m6A Modification. J Oncol. 2021;2021:7529164. Published 2021 Dec 7. doi:10.1155/2021/7529164(IF:4.375)
[21] Li K, Liu T, Chen J, Ni H, Li W. Survivin in breast cancer-derived exosomes activates fibroblasts by up-regulating SOD1, whose feedback promotes cancer proliferation and metastasis. J Biol Chem. 2020;295(40):13737-13752. doi:10.1074/jbc.RA120.013805(IF:4.238)
[22] Kong Y, Feng Z, Chen A, et al. The Natural Flavonoid Galangin Elicits Apoptosis, Pyroptosis, and Autophagy in Glioblastoma. Front Oncol. 2019;9:942. Published 2019 Sep 27. doi:10.3389/fonc.2019.00942(IF:4.137)
[23] Kong Y, Feng Z, Chen A, et al. The Natural Flavonoid Galangin Elicits Apoptosis, Pyroptosis, and Autophagy in Glioblastoma. Front Oncol. 2019;9:942. Published 2019 Sep 27. doi:10.3389/fonc.2019.00942(IF:4.137)
[24] Hu J, Wang Y, Yuan Y. Inhibitors of APE1 redox function effectively inhibit γ-herpesvirus replication in vitro and in vivo. Antiviral Res. 2021;185:104985. doi:10.1016/j.antiviral.2020.104985(IF:4.101)
[25] Li Q, Wei D, Feng F, et al. α2,6-linked sialic acid serves as a high-affinity receptor for cancer oncolytic virotherapy with Newcastle disease virus. J Cancer Res Clin Oncol. 2017;143(11):2171-2181. doi:10.1007/s00432-017-2470-y(IF:3.503)
[26] Han B, Jiang P, Liu W, et al. Role of Daucosterol Linoleate on Breast Cancer: Studies on Apoptosis and Metastasis. J Agric Food Chem. 2018;66(24):6031-6041. doi:10.1021/acs.jafc.8b01387(IF:3.412)
[27] Hu H, Zhang Z, Wang R, et al. BGC823 Cell Line with the Stable Expression of iRFP720 Retains Its Primary Properties with Promising Fluorescence Imaging Ability. DNA Cell Biol. 2020;39(5):900-908. doi:10.1089/dna.2019.5057(IF:3.314)
[28] Ni XR, Zhao YY, Cai HP, et al. Transferrin receptor 1 targeted optical imaging for identifying glioma margin in mouse models. J Neurooncol. 2020;148(2):245-258. doi:10.1007/s11060-020-03527-3(IF:3.267)
[29] Feng H, Tang J, Zhang P, Miao Y, Wu T, Cheng Z. Anti-adipogenic 18,19-seco-ursane stereoisomers and oleane-type saponins from Ilex cornuta leaves. Phytochemistry. 2020;175:112363. doi:10.1016/j.phytochem.2020.112363(IF:3.044)
[30] Zhao Y, Li T, Tian S, et al. Effective Inhibition of MYC-Amplified Group 3 Medulloblastoma Through Targeting EIF4A1. Cancer Manag Res. 2020;12:12473-12485. Published 2020 Dec 3. doi:10.2147/CMAR.S278844(IF:2.886)

