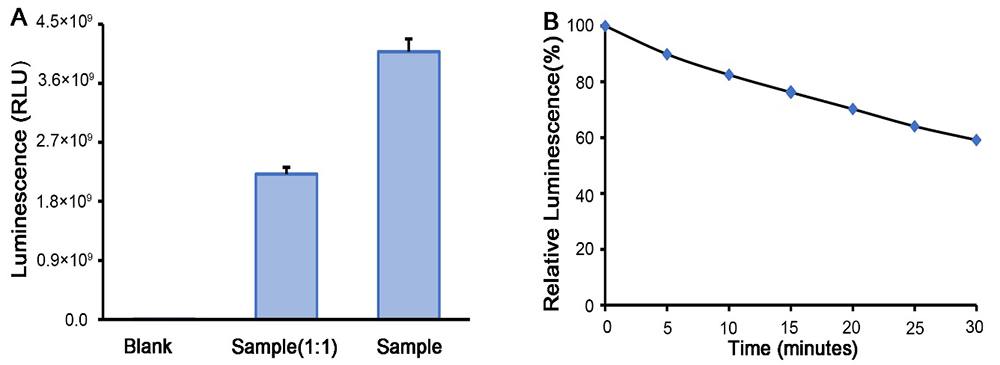
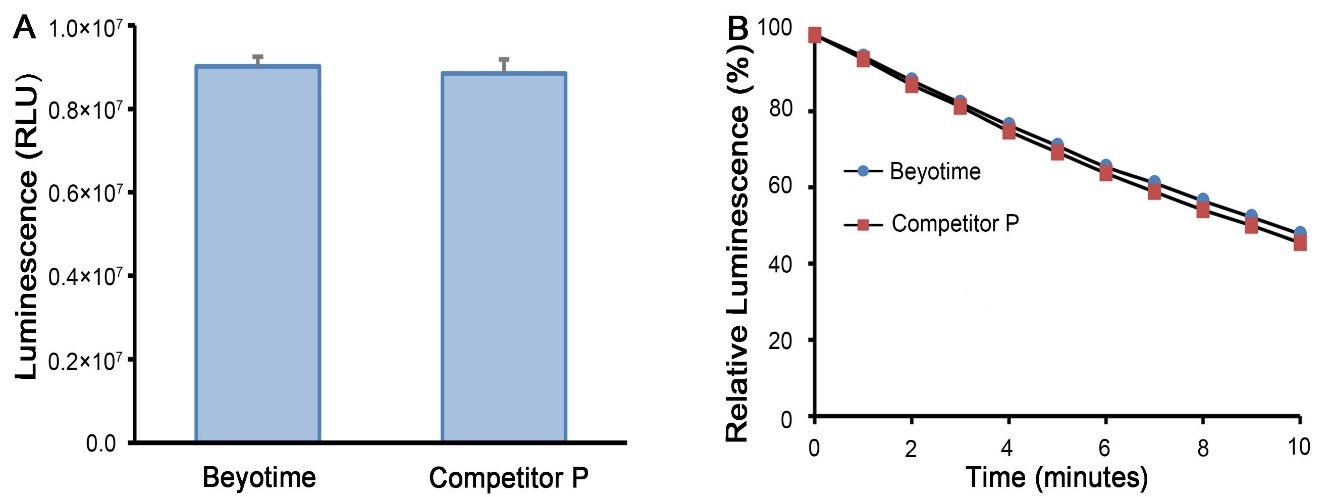
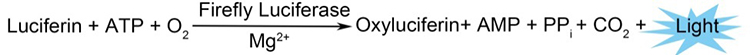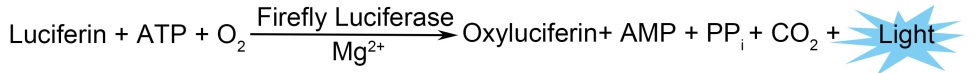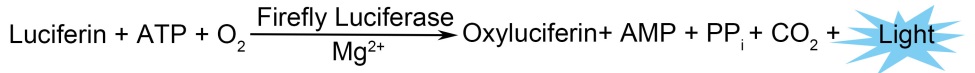双萤光素酶报告基因检测试剂盒|Dual Luciferase Reporter Gene Assay Kit
产品说明书
FAQ
COA
已发表文献
产品描述
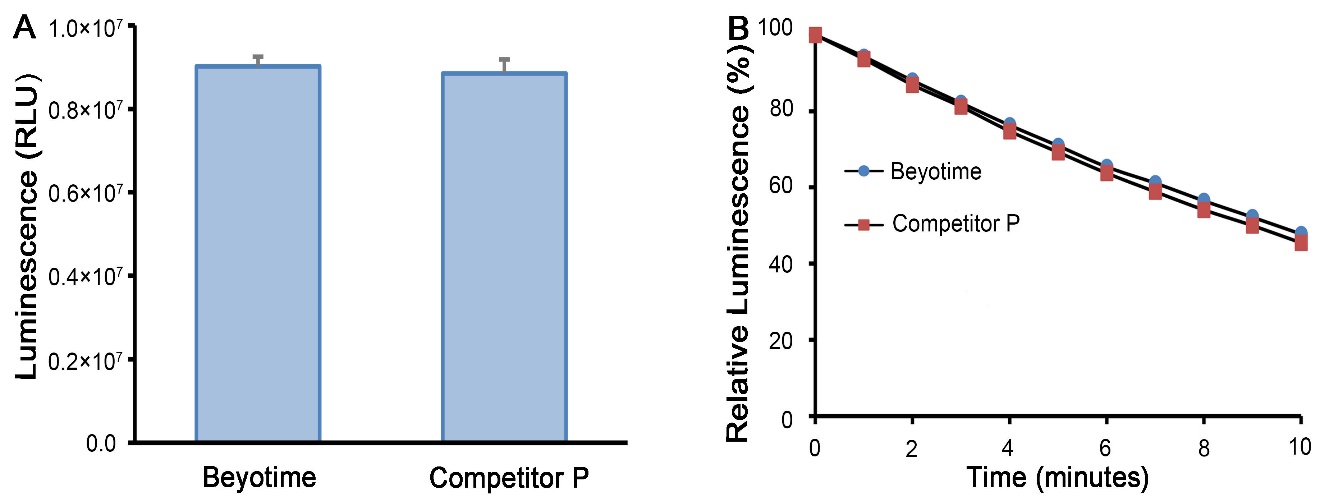
萤火虫萤光素酶(Firefly luciferase)是一种分子量约为61 kDa的蛋白,在ATP、镁离子和氧气存在的条件下,能够催化萤光素(luciferin)氧化成oxyluciferin,在氧化的过程中会发出波长为560 nm左右的生物萤光。海肾萤光素酶(Renilla luciferase)是一种分子量约为36 kDa的蛋白,在氧气存在的条件下,可以催化腔肠素(coelenterazine)氧化成coelenteramide,在氧化的过程中会发出波长为480nm左右的生物萤光。两种生物萤光都可通过化学发光仪进行测定。检测原理如图所示:
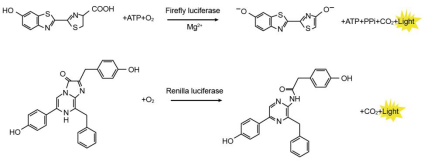
图1:萤火虫和海肾萤光素酶检测原理图
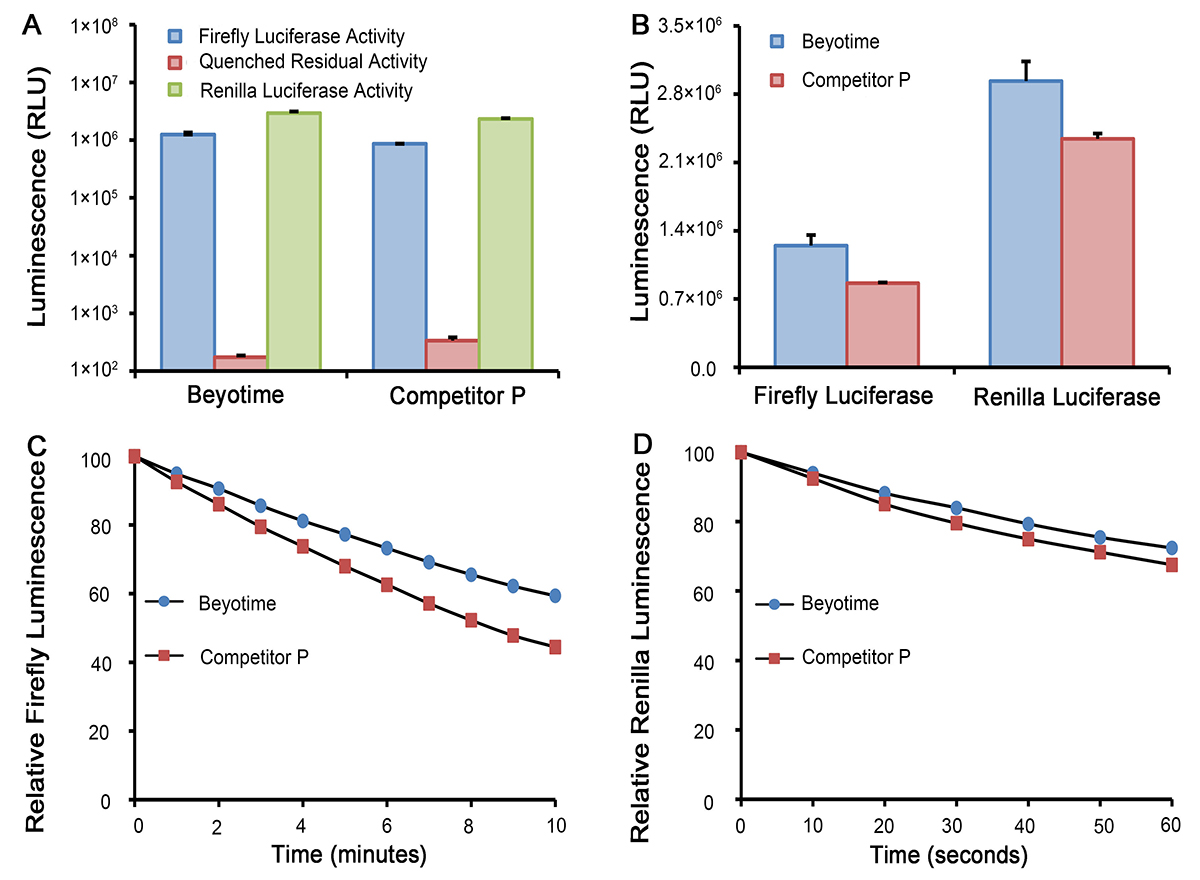
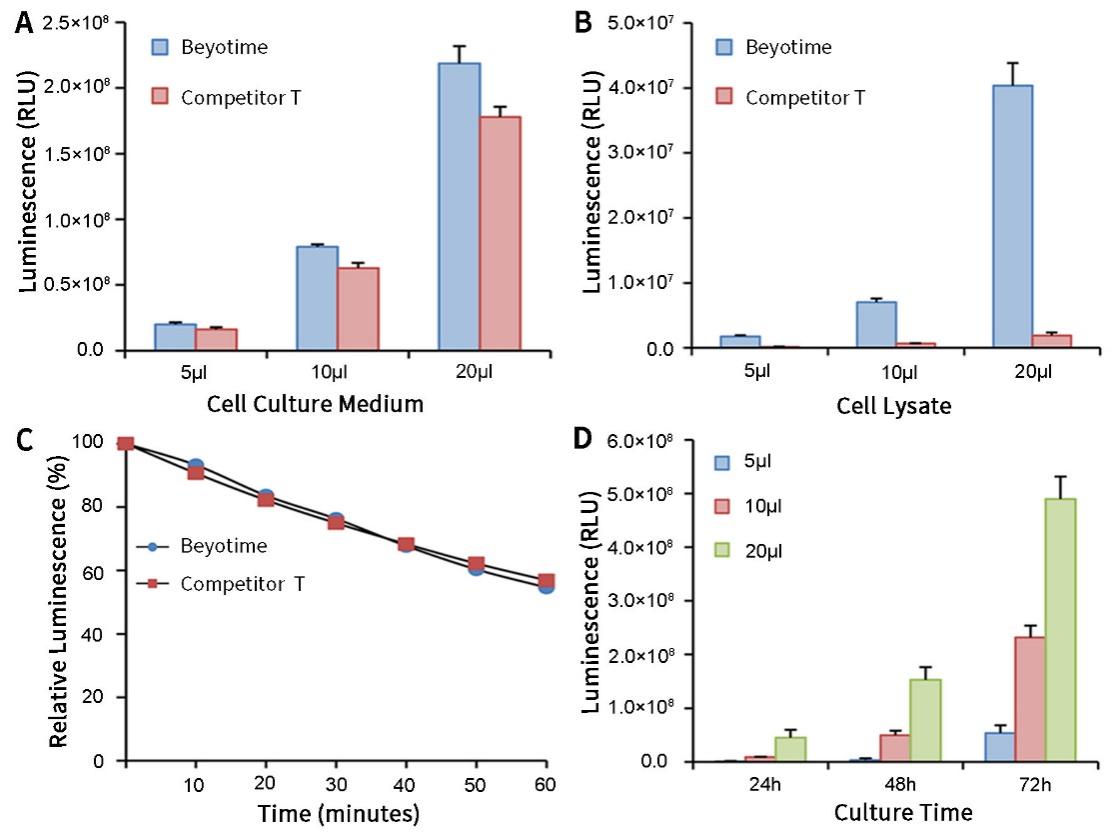
通常将目的基因的5´UTR或启动子克隆至Firefly Luciferase的上游,或3´UTR克隆至Firefly Luciferase的下游,通过检测萤火虫萤光素酶的量来检测启动子或调控元件的转录调控作用。Renilla Luciferase作为内参,来消除细胞数量、转染效率等的差异。Dual Luciferase Reporter Gene Assay Kit首先以萤光素为底物来检测萤火虫萤光素酶报告基因的活性,之后在淬灭该萤光反应的同时,以腔肠素为底物检测海肾萤光素酶报告基因的活性。该试剂盒具有灵敏度高的特点。
产品组分
|
组分编号 |
组分名称 |
产品编号/规格 |
|
|
11402JP60(100 T) |
11402JP80(1000 T) |
||
|
11402-A |
细胞裂解液 |
20 mL |
10×20 mL |
|
11402-B |
萤火虫萤光素酶缓冲液 |
10 mL |
10×10 mL |
|
11402-C |
萤火虫萤光素酶底物(50 ×) |
200 μL |
10×200 μL |
|
11402-D |
海肾萤光素酶缓冲液 |
10 mL |
10×10 mL |
|
11402-E |
海肾萤光素酶底物(50 ×) |
200 μL |
10×200 μL |
运输和保存方式
干冰运输。 -20℃保存,有效期1年。
萤火虫萤光素酶反应工作液和海肾萤光素酶反应工作液现配现用,且不能反复冻融,建议分装-20℃或-80℃分装保存。
实验步骤
I.前处理
1.细胞
1)构建相应的载体。
2)转染步骤请参照相关的说明书。
3)将细胞裂解液充分混匀,按如下方式加入细胞裂解液,充分裂解细胞。
a: 对于贴壁细胞,吸尽细胞培养液,按照下表比例加入细胞裂解液,轻轻旋转培养皿或者培养板使裂解液完全覆盖细胞;
b: 对于悬浮细胞,离心弃去上清,按照下表比例加入裂解液。
|
细胞培养板 |
96孔板 |
48孔板 |
24孔板 |
12孔板 |
6孔板 |
|
裂解液加入量 |
100 μL |
150 μL |
200 μL |
300 μL |
500 μL |
4)冰上孵育5 min,充分裂解细胞。
【注】:裂解产物可室温保存6 h;4℃保存16 h;–80℃可长期存放。(裂解产物不能多次反复冻融)。
5)(选作)10000-16000 rpm离心1 min,取上清。
2.叶片组织(以烟草叶片为例,仅供参考)
1)构建相应的载体。
2)挑取转化有重组质粒的农杆菌单菌落,接种到2 mL LB液体培养基(添加相应抗生素)中,28℃ 220 rpm培养过夜。
3)农杆菌培养至OD600为1.0,1700× g离心5 min收集菌体后,用1/2MS液体培养基清洗菌体2次;用含有150 μmol/L乙酰丁香酮的1/2MS液体培养基将农杆菌的OD600调至1.0。
4)将待检测的农杆菌菌液进行混合,使每种菌液的OD600为0.5。
5)选取生长期为1个月左右完全伸展的烟草叶片,将混合好的菌液用1 mL注射器(去掉针头)从烟草叶背面进行注射。为保证实验结果的一致性,需要将对照载体和待检测目标载体的菌液注射在同一叶片的不同部位上, 以保证相同的生长背景。
6)正常温室生长条件下,24-48 h即可取样观察。
7)取3-4片直径为6-8 mm的叶盘,放入2 mL的EP管(提前放入3-4个小钢珠)中,液氮中冷冻,使用破碎仪进行研磨破碎(45 Hz,30 s)。破碎完全后在EP管中加入100 μL裂解液。
8)冰上孵育5 min左右,充分裂解叶片。
9)10000-16000 rpm离心1 min,取上清。
3.原生质体(仅供参考)
1)构建相应的载体。
2)制备原生质体(参考文献:Yoo SD, Cho YH, Sheen J (2007). Arabidopsis mesophyll protoplasts: a versatile cell system for transient gene expression analysis. Nat Protoc 2, 1565–1572)。
3)WI溶液配置:0.5 M甘露醇和20mm KCl 溶于4 mm MJP (pH 5.7),可在室温下保存。
W5溶液配置:154 mM NaCl, 125 mM CaCl2 和5 mM KCl溶于2 mm MJP (pH 5.7),可在室温下保存。
4)在2 mL EP管中加入相应的载体(加入量需要摸索),加入100 μL原生质体悬浮液。轻摇混匀后,加入110 μL PEG-CaCl2溶液,轻弹混匀。在室温放置10-15 min。
5)加入440 μL W5溶液,上下颠倒以停止转化。
6)200 × g 室温离心5 min,弃去上清,加入800 μL WI溶液重悬原生质体。
7)室温避光培养16-24 h。
8)将原生质体加入2 mL离心管中,离心收集原生质体,加入100 μL左右的裂解液。
9)冰上孵育5 min左右,充分裂解原生质体。
10)(选做)10000-16000 rpm离心1 min,取上清。
II.萤光检测
1)取20 μL裂解液,加至培养板中。按照实验需要,可设置3孔-5孔重复。
2)配制萤火虫萤光素酶反应工作液和海肾萤光素酶反应液,即萤火虫萤光素酶底物(50 ×)和海肾萤光素酶底物(50 ×)分别用对应的缓冲液稀释至1 ×工作液。并孵育至室温。
3)加入100 μL萤火虫萤光素酶反应液,震板混匀,检测萤火虫萤光素酶的活力,检测尽量在30 min内完成。
4)加入100 μL海肾萤光素酶反应液,震板混匀,检测海肾萤光素酶的活力,检测尽量在30 min内完成。
5)分析数据。
①实验设计:根据不同实验目的,在每个培养板中都应设置对照组、实验组和空白对照组。为了保证实验准确性,理论上每个实验组(包括对照组)都应当减去空白对照组的萤火虫和海肾萤光素酶的发光测量值。
a.空白对照组:
背景F:未转染细胞+萤火虫萤光素酶检测试剂。
背景R:未转染细胞+萤火虫萤光素酶检测试剂+海肾萤光素酶检测试剂。
注:空白对照组的样品量必须与实验样品量相同,包含与实验样品相同的培养基/血清组合,并加上完全相同的检测试剂。
b.实验组:转染细胞经实验化合物处理(即实验组F和实验组R)。
c.对照组:转染细胞不经处理,用以标准化结果(即对照组F和对照组R)。
②计算结果:
实验组比值=(实验组F-背景F)/(实验组R-背景R)。
对照组比值=(对照组F-背景F)/(对照组R-背景R)。
表达倍数=实验组比值/对照组比值。

图2:细胞样品萤火虫和海肾萤光素酶检测流程图
注意事项
1)检测过程中需自备耗材和设备包括如下:PBS、100 μL移液器或者排枪、不透光白色酶标板、Luminometer发光计、多功能酶标仪或者其他能够检测生物发光的仪器;
2)反应温度:酶促反应对温度较为敏感,加样检测前务必将所有试剂平衡至室温(20-25℃)再使用;
3)检测仪器:能检测化学发光的仪器都适用,但由于不同仪器的设置和灵敏度不同,测得的光信号值也会不同;
4)检测设置:Luminescence,350-700 nm,建议检测时间设为2-10 sec;
5)检测板:为防止孔间干扰,推荐使用不透光白色酶标板。黑色酶标板也可用,但因黑色会吸收光信号,可能会降低信号;
6)单管萤光测定仪测定,每个样品与测定试剂混合后到测定前的时间应保持一致;
7)E组分海肾萤光素酶底物易挥发,注意密封保存;
8)为了您的安全和健康,请穿实验服并戴一次性手套。
9)本产品仅作科研用途!
相关产品
|
产品名称 |
货号 |
规格 |
|
Firefly Glo Luciferase Reporter Gene Assay Kit辉光型萤火虫萤光素酶报告基因检测试剂盒 |
11404JP60/80 |
100/1000 T |
|
Dual Glo Luciferase Reporter Gene Assay Kit 辉光型双萤光素酶报告基因检测试剂盒 |
11405JP60/80 |
100/1000 T |
|
Luciferase Reporter Gene Assay Kit 萤火虫萤光素酶报告基因检测试剂盒 |
11401JP60/76/80 |
100/500/1000 T |
|
pGM-CMV Luciferase Reporter Plasmid Positive Control pGM-CMV-Luc萤光素酶报告基因质粒阳性对照 |
11556JP03 |
1 μg |
|
Luciferase Reporter Plasmid negative control (萤光素酶报告基因质粒阴性对照) |
11555JP03 |
1 μg |
|
pGMLR-TK Luciferase Reporter Plasmid(pGMLR-TK海肾萤光素酶报告基因质粒) |
11557JP03 |
1 μg |
|
pGMLR-CMV Luciferase Reporter Plasmid(pGMLR-CMV海肾萤光素酶报告基因质粒) |
11558JP03 |
1 μg |
|
Hieff Trans Liposomal Transfection Reagent 脂质体核酸转染试剂 |
40802JP03 |
1 mL |
HB230504
产品描述
萤火虫萤光素酶(Firefly luciferase)是一种分子量约为61 kDa的蛋白,在ATP、镁离子和氧气存在的条件下,能够催化萤光素(luciferin)氧化成oxyluciferin,在氧化的过程中会发出波长为560 nm左右的生物萤光。海肾萤光素酶(Renilla luciferase)是一种分子量约为36 kDa的蛋白,在氧气存在的条件下,可以催化腔肠素(coelenterazine)氧化成coelenteramide,在氧化的过程中会发出波长为480nm左右的生物萤光。两种生物萤光都可通过化学发光仪进行测定。检测原理如图所示:
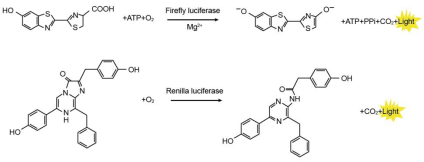
图1:萤火虫和海肾萤光素酶检测原理图
通常将目的基因的5´UTR或启动子克隆至Firefly Luciferase的上游,或3´UTR克隆至Firefly Luciferase的下游,通过检测萤火虫萤光素酶的量来检测启动子或调控元件的转录调控作用。Renilla Luciferase作为内参,来消除细胞数量、转染效率等的差异。Dual Luciferase Reporter Gene Assay Kit首先以萤光素为底物来检测萤火虫萤光素酶报告基因的活性,之后在淬灭该萤光反应的同时,以腔肠素为底物检测海肾萤光素酶报告基因的活性。该试剂盒具有灵敏度高的特点。
产品组分
|
组分编号 |
组分名称 |
产品编号/规格 |
|
|
11402JP60(100 T) |
11402JP80(1000 T) |
||
|
11402-A |
细胞裂解液 |
20 mL |
10×20 mL |
|
11402-B |
萤火虫萤光素酶缓冲液 |
10 mL |
10×10 mL |
|
11402-C |
萤火虫萤光素酶底物(50 ×) |
200 μL |
10×200 μL |
|
11402-D |
海肾萤光素酶缓冲液 |
10 mL |
10×10 mL |
|
11402-E |
海肾萤光素酶底物(50 ×) |
200 μL |
10×200 μL |
运输和保存方式
干冰运输。 -20℃保存,有效期1年。
萤火虫萤光素酶反应工作液和海肾萤光素酶反应工作液现配现用,且不能反复冻融,建议分装-20℃或-80℃分装保存。
实验步骤
I.前处理
1.细胞
1)构建相应的载体。
2)转染步骤请参照相关的说明书。
3)将细胞裂解液充分混匀,按如下方式加入细胞裂解液,充分裂解细胞。
a: 对于贴壁细胞,吸尽细胞培养液,按照下表比例加入细胞裂解液,轻轻旋转培养皿或者培养板使裂解液完全覆盖细胞;
b: 对于悬浮细胞,离心弃去上清,按照下表比例加入裂解液。
|
细胞培养板 |
96孔板 |
48孔板 |
24孔板 |
12孔板 |
6孔板 |
|
裂解液加入量 |
100 μL |
150 μL |
200 μL |
300 μL |
500 μL |
4)冰上孵育5 min,充分裂解细胞。
【注】:裂解产物可室温保存6 h;4℃保存16 h;–80℃可长期存放。(裂解产物不能多次反复冻融)。
5)(选作)10000-16000 rpm离心1 min,取上清。
2.叶片组织(以烟草叶片为例,仅供参考)
1)构建相应的载体。
2)挑取转化有重组质粒的农杆菌单菌落,接种到2 mL LB液体培养基(添加相应抗生素)中,28℃ 220 rpm培养过夜。
3)农杆菌培养至OD600为1.0,1700× g离心5 min收集菌体后,用1/2MS液体培养基清洗菌体2次;用含有150 μmol/L乙酰丁香酮的1/2MS液体培养基将农杆菌的OD600调至1.0。
4)将待检测的农杆菌菌液进行混合,使每种菌液的OD600为0.5。
5)选取生长期为1个月左右完全伸展的烟草叶片,将混合好的菌液用1 mL注射器(去掉针头)从烟草叶背面进行注射。为保证实验结果的一致性,需要将对照载体和待检测目标载体的菌液注射在同一叶片的不同部位上, 以保证相同的生长背景。
6)正常温室生长条件下,24-48 h即可取样观察。
7)取3-4片直径为6-8 mm的叶盘,放入2 mL的EP管(提前放入3-4个小钢珠)中,液氮中冷冻,使用破碎仪进行研磨破碎(45 Hz,30 s)。破碎完全后在EP管中加入100 μL裂解液。
8)冰上孵育5 min左右,充分裂解叶片。
9)10000-16000 rpm离心1 min,取上清。
3.原生质体(仅供参考)
1)构建相应的载体。
2)制备原生质体(参考文献:Yoo SD, Cho YH, Sheen J (2007). Arabidopsis mesophyll protoplasts: a versatile cell system for transient gene expression analysis. Nat Protoc 2, 1565–1572)。
3)WI溶液配置:0.5 M甘露醇和20mm KCl 溶于4 mm MJP (pH 5.7),可在室温下保存。
W5溶液配置:154 mM NaCl, 125 mM CaCl2 和5 mM KCl溶于2 mm MJP (pH 5.7),可在室温下保存。
4)在2 mL EP管中加入相应的载体(加入量需要摸索),加入100 μL原生质体悬浮液。轻摇混匀后,加入110 μL PEG-CaCl2溶液,轻弹混匀。在室温放置10-15 min。
5)加入440 μL W5溶液,上下颠倒以停止转化。
6)200 × g 室温离心5 min,弃去上清,加入800 μL WI溶液重悬原生质体。
7)室温避光培养16-24 h。
8)将原生质体加入2 mL离心管中,离心收集原生质体,加入100 μL左右的裂解液。
9)冰上孵育5 min左右,充分裂解原生质体。
10)(选做)10000-16000 rpm离心1 min,取上清。
II.萤光检测
1)取20 μL裂解液,加至培养板中。按照实验需要,可设置3孔-5孔重复。
2)配制萤火虫萤光素酶反应工作液和海肾萤光素酶反应液,即萤火虫萤光素酶底物(50 ×)和海肾萤光素酶底物(50 ×)分别用对应的缓冲液稀释至1 ×工作液。并孵育至室温。
3)加入100 μL萤火虫萤光素酶反应液,震板混匀,检测萤火虫萤光素酶的活力,检测尽量在30 min内完成。
4)加入100 μL海肾萤光素酶反应液,震板混匀,检测海肾萤光素酶的活力,检测尽量在30 min内完成。
5)分析数据。
①实验设计:根据不同实验目的,在每个培养板中都应设置对照组、实验组和空白对照组。为了保证实验准确性,理论上每个实验组(包括对照组)都应当减去空白对照组的萤火虫和海肾萤光素酶的发光测量值。
a.空白对照组:
背景F:未转染细胞+萤火虫萤光素酶检测试剂。
背景R:未转染细胞+萤火虫萤光素酶检测试剂+海肾萤光素酶检测试剂。
注:空白对照组的样品量必须与实验样品量相同,包含与实验样品相同的培养基/血清组合,并加上完全相同的检测试剂。
b.实验组:转染细胞经实验化合物处理(即实验组F和实验组R)。
c.对照组:转染细胞不经处理,用以标准化结果(即对照组F和对照组R)。
②计算结果:
实验组比值=(实验组F-背景F)/(实验组R-背景R)。
对照组比值=(对照组F-背景F)/(对照组R-背景R)。
表达倍数=实验组比值/对照组比值。

图2:细胞样品萤火虫和海肾萤光素酶检测流程图
注意事项
1)检测过程中需自备耗材和设备包括如下:PBS、100 μL移液器或者排枪、不透光白色酶标板、Luminometer发光计、多功能酶标仪或者其他能够检测生物发光的仪器;
2)反应温度:酶促反应对温度较为敏感,加样检测前务必将所有试剂平衡至室温(20-25℃)再使用;
3)检测仪器:能检测化学发光的仪器都适用,但由于不同仪器的设置和灵敏度不同,测得的光信号值也会不同;
4)检测设置:Luminescence,350-700 nm,建议检测时间设为2-10 sec;
5)检测板:为防止孔间干扰,推荐使用不透光白色酶标板。黑色酶标板也可用,但因黑色会吸收光信号,可能会降低信号;
6)单管萤光测定仪测定,每个样品与测定试剂混合后到测定前的时间应保持一致;
7)E组分海肾萤光素酶底物易挥发,注意密封保存;
8)为了您的安全和健康,请穿实验服并戴一次性手套。
9)本产品仅作科研用途!
相关产品
|
产品名称 |
货号 |
规格 |
|
Firefly Glo Luciferase Reporter Gene Assay Kit辉光型萤火虫萤光素酶报告基因检测试剂盒 |
11404JP60/80 |
100/1000 T |
|
Dual Glo Luciferase Reporter Gene Assay Kit 辉光型双萤光素酶报告基因检测试剂盒 |
11405JP60/80 |
100/1000 T |
|
Luciferase Reporter Gene Assay Kit 萤火虫萤光素酶报告基因检测试剂盒 |
11401JP60/76/80 |
100/500/1000 T |
|
pGM-CMV Luciferase Reporter Plasmid Positive Control pGM-CMV-Luc萤光素酶报告基因质粒阳性对照 |
11556JP03 |
1 μg |
|
Luciferase Reporter Plasmid negative control (萤光素酶报告基因质粒阴性对照) |
11555JP03 |
1 μg |
|
pGMLR-TK Luciferase Reporter Plasmid(pGMLR-TK海肾萤光素酶报告基因质粒) |
11557JP03 |
1 μg |
|
pGMLR-CMV Luciferase Reporter Plasmid(pGMLR-CMV海肾萤光素酶报告基因质粒) |
11558JP03 |
1 μg |
|
Hieff Trans Liposomal Transfection Reagent 脂质体核酸转染试剂 |
40802JP03 |
1 mL |
HB230504
Q:细胞裂解之后的裂解液能否在-80℃保存?
A:可保存在-80℃,基本与蛋白的保存方法类似。裂解后的样本可在 -80 ℃保存半年,-20 ℃保存一个月。
Q:双荧光素酶报告基因检测试剂盒中的两个底物是否需要避光的?
A:这两个底物操作过程中不需要严格避光。保存的时候避光保存,更重要的保存条件是低温,尤其是腔肠素,推荐–80℃保存。
Q:双荧光素酶报告基因载体共转染时比例该如何进行优化与调整?
A:比例:根据具体实验情况进行调整。建议做预实验:如海参载体与萤火虫载体比例分别用 1:10、1:20、1:50、1:100。萤火虫荧光素酶检测发光值大于海参荧光素酶发光值的比例比较好。
Q:海肾和萤火虫是在同一个孔里面检测吗?萤火虫的萤光不会影响海肾的萤光吗?能否分开检测呢?
A:同一个孔里检测。不会相互影响,我们的海肾荧光素酶底物中有淬灭萤火虫荧光值的物质。可以分开检测,但是在一个孔里检测会更加准确。
Q:使用的是promega的仪器进行检测,发现海肾的本底值偏高很多,是为什么呢?
A:我们的产品与promega的仪器不适配,会导致本底值偏高。使用酶标仪检测不会出现这种情况,建议使用酶标仪检测。
Q:W5和WI指的是什么呢?
A:
WI solution Prepare 4 mM MJP (pH 5.7) containing 0.5 M mannitol and 20 mM KCl. The prepared WI solution can be stored at room temperature (22-25 °C).
W5 solution Prepare 2 mM MJP (pH 5.7) containing 154 mM NaCl, 125 mM CaCl2 and 5 mM KCl. The prepared W5 solution can be stored at room temperature.
Q:检测萤火虫荧光素酶,酶标仪使用什么样的板子呢?
A:白色不透明的酶标板,图片见说明书
Q:裂解液不够用了,怎么办呢?
A:10ml PBS里加入0.3ml Triton
[1] Wang Z, Lu Z, Lin S, et al. Leucine-tRNA-synthase-2-expressing B cells contribute to colorectal cancer immunoevasion. Immunity. 2022;55(6):1067-1081.e8. doi:10.1016/j.immuni.2022.04.017(IF:43.474)
[2] Chen Y, Lu Z, Qi C, et al. N6-methyladenosine-modified TRAF1 promotes sunitinib resistance by regulating apoptosis and angiogenesis in a METTL14-dependent manner in renal cell carcinoma. Mol Cancer. 2022;21(1):111. Published 2022 May 10. doi:10.1186/s12943-022-01549-1(IF:27.401)
[3] Yao J, Wu D, Zhang C, et al. Macrophage IRX3 promotes diet-induced obesity and metabolic inflammation. Nat Immunol. 2021;22(10):1268-1279. doi:10.1038/s41590-021-01023-y(IF:25.606)
[4] Sun B, Yang X, Hou F, et al. Regulation of host and virus genes by neuronal miR-138 favours herpes simplex virus 1 latency. Nat Microbiol. 2021;6(5):682-696. doi:10.1038/s41564-020-00860-1(IF:17.745)
[5] Tian WH, Ye JY, Cui MQ, et al. A transcription factor STOP1-centered pathway coordinates ammonium and phosphate acquisition in Arabidopsis. Mol Plant. 2021;14(9):1554-1568. doi:10.1016/j.molp.2021.06.024(IF:13.164)
[6] Qiao J, Jiang H, Lin Y, et al. A novel miR167a-OsARF6-OsAUX3 module regulates grain length and weight in rice. Mol Plant. 2021;14(10):1683-1698. doi:10.1016/j.molp.2021.06.023(IF:13.164)
[7] Wang Y, Wang Z, Shao C, et al. Melatonin may suppress lung adenocarcinoma progression via regulation of the circular noncoding RNA hsa_circ_0017109/miR-135b-3p/TOX3 axis [published online ahead of print, 2022 Jun 4]. J Pineal Res. 2022;e12813. doi:10.1111/jpi.12813(IF:13.007)
[8] Chen H, Moreno-Moral A, Pesce F, et al. WWP2 regulates pathological cardiac fibrosis by modulating SMAD2 signaling [published correction appears in Nat Commun. 2019 Sep 9;10(1):4085]. Nat Commun. 2019;10(1):3616. Published 2019 Aug 9. doi:10.1038/s41467-019-11551-9(IF:11.878)
[9] Xiang X, Fu Y, Zhao K, et al. Cellular senescence in hepatocellular carcinoma induced by a long non-coding RNA-encoded peptide PINT87aa by blocking FOXM1-mediated PHB2. Theranostics. 2021;11(10):4929-4944. Published 2021 Mar 4. doi:10.7150/thno.55672(IF:11.556)
[10] Xu Y, Jiang Y, Wang Y, et al. LINC00473-modified bone marrow mesenchymal stem cells incorporated thermosensitive PLGA hydrogel transplantation for steroid-induced osteonecrosis of femoral head: A detailed mechanistic study and validity evaluation. Bioeng Transl Med. 2021;7(2):e10275. Published 2021 Dec 8. doi:10.1002/btm2.10275(IF:10.711)
[11] Huang X, He M, Huang S, et al. Circular RNA circERBB2 promotes gallbladder cancer progression by regulating PA2G4-dependent rDNA transcription [published correction appears in Mol Cancer. 2022 Jun 2;21(1):122]. Mol Cancer. 2019;18(1):166. Published 2019 Nov 21. doi:10.1186/s12943-019-1098-8(IF:10.679)
[12] Ma L, An R, Jiang L, et al. Effects of ZmHIPP on lead tolerance in maize seedlings: Novel ideas for soil bioremediation. J Hazard Mater. 2022;430:128457. doi:10.1016/j.jhazmat.2022.128457(IF:10.588)
[13] Xu C, Fan L, Lin Y, et al. Fusobacterium nucleatum promotes colorectal cancer metastasis through miR-1322/CCL20 axis and M2 polarization. Gut Microbes. 2021;13(1):1980347. doi:10.1080/19490976.2021.1980347(IF:10.245)
[14] Xiang Y, Bian X, Wei T, et al. ZmMPK5 phosphorylates ZmNAC49 to enhance oxidative stress tolerance in maize. New Phytol. 2021;232(6):2400-2417. doi:10.1111/nph.17761(IF:10.152)
[15] Gao Y, Li Z, Yang C, et al. Pseudomonas syringae activates ZAT18 to inhibit salicylic acid accumulation by repressing EDS1 transcription for bacterial infection. New Phytol. 2022;233(3):1274-1288. doi:10.1111/nph.17870(IF:10.152)
[16] Zhao H, Lu J, Yan T, et al. Opioid receptor signaling suppresses leukemia through both catalytic and non-catalytic functions of TET2. Cell Rep. 2022;38(4):110253. doi:10.1016/j.celrep.2021.110253(IF:9.423)
[17] He R, Shi J, Xu D, et al. SULF2 enhances GDF15-SMAD axis to facilitate the initiation and progression of pancreatic cancer. Cancer Lett. 2022;538:215693. doi:10.1016/j.canlet.2022.215693(IF:8.679)
[18] Wu Q, Li L, Miao C, et al. Osteopontin promotes hepatocellular carcinoma progression through inducing JAK2/STAT3/NOX1-mediated ROS production. Cell Death Dis. 2022;13(4):341. Published 2022 Apr 13. doi:10.1038/s41419-022-04806-9(IF:8.469)
[19] Wu Y, Wang L, Ansah EO, et al. The sucrose transport regulator OsDOF11 mediates cytokinin degradation during rice development. Plant Physiol. 2022;189(2):1083-1094. doi:10.1093/plphys/kiac104(IF:8.340)
[20] Ruan J, Chen H, Zhu T, et al. Brassinosteroids repress the seed maturation program during the seed-to-seedling transition. Plant Physiol. 2021;186(1):534-548. doi:10.1093/plphys/kiab089(IF:8.340)
[21] Hou Y, Lu H, Li J, et al. A photoaffinity labeling strategy identified EF1A1 as a binding protein of cyclic dinucleotide 2'3'-cGAMP. Cell Chem Biol. 2022;29(1):133-144.e20. doi:10.1016/j.chembiol.2021.08.006(IF:8.116)
[22] Cao L, Zhang Y, Mi J, et al. α-Hederin inhibits the platelet activating factor-induced metastasis of HCC cells through disruption of PAF/PTAFR axis cascaded STAT3/MMP-2 expression. Pharmacol Res. 2022;178:106180. doi:10.1016/j.phrs.2022.106180(IF:7.658)
[23] Xie S, Wei H, Peng A, et al. Ikzf2 Regulates the Development of ICOS+ Th Cells to Mediate Immune Response in the Spleen of S. japonicum-Infected C57BL/6 Mice. Front Immunol. 2021;12:687919. Published 2021 Aug 12. doi:10.3389/fimmu.2021.687919(IF:7.561)
[24] Song Y, Guo Y, Li X, et al. RBM39 Alters Phosphorylation of c-Jun and Binds to Viral RNA to Promote PRRSV Proliferation. Front Immunol. 2021;12:664417. Published 2021 May 17. doi:10.3389/fimmu.2021.664417(IF:7.561)
[25] Zeng J, Li G, Xia Y, et al. miR-204/COX5A axis contributes to invasion and chemotherapy resistance in estrogen receptor-positive breast cancers. Cancer Lett. 2020;492:185-196. doi:10.1016/j.canlet.2020.07.027(IF:7.360)
[26] Li D, Zhou J, Zheng C, et al. OsTGAL1 suppresses the resistance of rice to bacterial blight disease by regulating the expression of salicylic acid glucosyltransferase OsSGT1. Plant Cell Environ. 2022;45(5):1584-1602. doi:10.1111/pce.14288(IF:7.228)
[27] Sun J, Shi Y, Shi H, et al. Intracellular Low Iron Exerts Anti-BK Polyomavirus Effect by Inhibiting the Protein Synthesis of Exogenous Genes. Microbiol Spectr. 2021;9(3):e0109421. doi:10.1128/Spectrum.01094-21(IF:7.171)
[28] Sun Q, Xu Y, Yuan F, et al. Rho family GTPase 1 (RND1), a novel regulator of p53, enhances ferroptosis in glioblastoma. Cell Biosci. 2022;12(1):53. Published 2022 May 3. doi:10.1186/s13578-022-00791-w(IF:7.133)
[29] Yuan F, Sun Q, Zhang S, et al. The dual role of p62 in ferroptosis of glioblastoma according to p53 status. Cell Biosci. 2022;12(1):20. Published 2022 Feb 25. doi:10.1186/s13578-022-00764-z(IF:7.133)
[30] Liu J, Gao L, Zhan N, et al. Hypoxia induced ferritin light chain (FTL) promoted epithelia mesenchymal transition and chemoresistance of glioma. J Exp Clin Cancer Res. 2020;39(1):137. Published 2020 Jul 16. doi:10.1186/s13046-020-01641-8(IF:7.068)
[31] Sun C, Li D, Gao Z, et al. OsRLR4 binds to the OsAUX1 promoter to negatively regulate primary root development in rice [published correction appears in J Integr Plant Biol. 2022 May;64(5):1131]. J Integr Plant Biol. 2022;64(1):118-134. doi:10.1111/jipb.13183(IF:7.061)
[32] Xiang Y, Sun X, Bian X, et al. The transcription factor ZmNAC49 reduces stomatal density and improves drought tolerance in maize. J Exp Bot. 2021;72(4):1399-1410. doi:10.1093/jxb/eraa507(IF:6.992)
[33] Zhou H, Li X, Wu RX, et al. Periodontitis-compromised dental pulp stem cells secrete extracellular vesicles carrying miRNA-378a promote local angiogenesis by targeting Sufu to activate the Hedgehog/Gli1 signalling. Cell Prolif. 2021;54(5):e13026. doi:10.1111/cpr.13026(IF:6.831)
[34] Tao J, Li S, Wang Q, et al. Construction of a high-density genetic map based on specific-locus amplified fragment sequencing and identification of loci controlling anthocyanin pigmentation in Yunnan red radish [published online ahead of print, 2022 Jan 19]. Hortic Res. 2022;9:uhab031. doi:10.1093/hr/uhab031(IF:6.793)
[35] Ma X, Yuan Y, Li C, et al. Brassinosteroids suppress ethylene-induced fruitlet abscission through LcBZR1/2-mediated transcriptional repression of LcACS1/4 and LcACO2/3 in litchi. Hortic Res. 2021;8(1):105. Published 2021 May 1. doi:10.1038/s41438-021-00540-z(IF:6.793)
[36] Zhang R, Chang J, Li J, et al. Disruption of the bHLH transcription factor Abnormal Tapetum 1 causes male sterility in watermelon. Hortic Res. 2021;8(1):258. Published 2021 Dec 1. doi:10.1038/s41438-021-00695-9(IF:6.793)
[37] Sun Y, Wang L, Xu X, et al. FOXO4 Inhibits the Migration and Metastasis of Colorectal Cancer by Regulating the APC2/β-Catenin Axis. Front Cell Dev Biol. 2021;9:659731. Published 2021 Sep 23. doi:10.3389/fcell.2021.659731(IF:6.684)
[38] Zhang Y, Hu R, Xi B, Nie D, Xu H, Liu A. Mechanisms of Senescence-Related NKG2D Ligands Release and Immune Escape Induced by Chemotherapy in Neuroblastoma Cells. Front Cell Dev Biol. 2022;10:829404. Published 2022 Mar 2. doi:10.3389/fcell.2022.829404(IF:6.684)
[39] Zhu L, Qi W, Yang G, et al. Toxoplasma gondii Rhoptry Protein 7 (ROP7) Interacts with NLRP3 and Promotes Inflammasome Hyperactivation in THP-1-Derived Macrophages. Cells. 2022;11(10):1630. Published 2022 May 12. doi:10.3390/cells11101630(IF:6.600)
[40] Zeng H, Li L, Gao Y, Wu G, Hou Z, Liu S. Long noncoding RNA UCA1 regulates HCV replication and antiviral response via miR-145-5p/SOCS7/IFN pathway. Int J Biol Sci. 2021;17(11):2826-2840. Published 2021 Jul 5. doi:10.7150/ijbs.59227(IF:6.582)
[41] Zhao P, Zhu Y, Sun L, et al. Circulating Exosomal miR-1-3p from Rats with Myocardial Infarction Plays a Protective Effect on Contrast-Induced Nephropathy via Targeting ATG13 and activating the AKT Signaling Pathway. Int J Biol Sci. 2021;17(4):972-985. Published 2021 Mar 2. doi:10.7150/ijbs.55887(IF:6.582)
[42] Cui W, Wang S, Han K, et al. Ferredoxin 1 is downregulated by the accumulation of abscisic acid in an ABI5-dependent manner to facilitate rice stripe virus infection in Nicotiana benthamiana and rice. Plant J. 2021;107(4):1183-1197. doi:10.1111/tpj.15377(IF:6.486)
[43] Wang Y, He S, Long Y, et al. Genetic variations in ZmSAUR15 contribute to the formation of immature embryo-derived embryonic calluses in maize. Plant J. 2022;109(4):980-991. doi:10.1111/tpj.15609(IF:6.486)
[44] Tang C, Wang X, Ji C, et al. The Role of miR-640: A Potential Suppressor in Breast Cancer via Wnt7b/β-catenin Signaling Pathway. Front Oncol. 2021;11:645682. Published 2021 Apr 12. doi:10.3389/fonc.2021.645682(IF:6.244)
[45] Meng X, Deng Y, He S, Niu L, Zhu H. m6A-Mediated Upregulation of LINC00857 Promotes Pancreatic Cancer Tumorigenesis by Regulating the miR-150-5p/E2F3 Axis. Front Oncol. 2021;11:629947. Published 2021 Feb 18. doi:10.3389/fonc.2021.629947(IF:6.244)
[46] Yu Q, Zhang W, Zhou X, Shen W, Xing C, Yang X. Regulation of lnc-TLCD2-1 on Radiation Sensitivity of Colorectal Cancer and Comprehensive Analysis of Its Mechanism. Front Oncol. 2021;11:714159. Published 2021 Jul 15. doi:10.3389/fonc.2021.714159(IF:6.244)
[47] Zhang XY, Chen ZC, Li N, et al. Exosomal transfer of activated neutrophil-derived lncRNA CRNDE promotes proliferation and migration of airway smooth muscle cells in asthma. Hum Mol Genet. 2022;31(4):638-650. doi:10.1093/hmg/ddab283(IF:6.150)
[48] Yang HY, Liu M, Sheng Y, et al. All-trans retinoic acid impairs glucose-stimulated insulin secretion by activating the RXR/SREBP-1c/UCP2 pathway. Acta Pharmacol Sin. 2022;43(6):1441-1452. doi:10.1038/s41401-021-00740-2(IF:6.150)
[49] Jiang T, Peng D, Shi W, et al. IL-6/STAT3 Signaling Promotes Cardiac Dysfunction by Upregulating FUNDC1-Dependent Mitochondria-Associated Endoplasmic Reticulum Membranes Formation in Sepsis Mice. Front Cardiovasc Med. 2022;8:790612. Published 2022 Jan 18. doi:10.3389/fcvm.2021.790612(IF:6.050)
[50] Ji H, Zhang K, Pan G, et al. Deoxyelephantopin Induces Apoptosis and Enhances Chemosensitivity of Colon Cancer via miR-205/Bcl2 Axis. Int J Mol Sci. 2022;23(9):5051. Published 2022 May 2. doi:10.3390/ijms23095051(IF:5.924)
[51] Li H, Luo Y, Ma B, et al. Hierarchical Action of Mulberry miR156 in the Vegetative Phase Transition. Int J Mol Sci. 2021;22(11):5550. Published 2021 May 24. doi:10.3390/ijms22115550(IF:5.924)
[52] Li H, Ma B, Luo Y, et al. The Mulberry SPL Gene Family and the Response of MnSPL7 to Silkworm Herbivory through Activating the Transcription of MnTT2L2 in the Catechin Biosynthesis Pathway. Int J Mol Sci. 2022;23(3):1141. Published 2022 Jan 20. doi:10.3390/ijms23031141(IF:5.924)
[53] Xia S, Wang Z, Chen L, et al. Dihydroartemisinin regulates lipid droplet metabolism in hepatic stellate cells by inhibiting lncRNA-H19-induced AMPK signal. Biochem Pharmacol. 2021;192:114730. doi:10.1016/j.bcp.2021.114730(IF:5.858)
[54] Feng Y, He PY, Kong WD, et al. Apoptosis-promoting properties of miR-3074-5p in MC3T3-E1 cells under iron overload conditions. Cell Mol Biol Lett. 2021;26(1):37. Published 2021 Aug 16. doi:10.1186/s11658-021-00281-w(IF:5.787)
[55] Li D, Wang Z, Sun S, et al. VvMYB15 and VvWRKY40 Positively Co-regulated Anthocyanin Biosynthesis in Grape Berries in Response to Root Restriction [published correction appears in Front Plant Sci. 2022 Feb 22;13:850160]. Front Plant Sci. 2021;12:789002. Published 2021 Dec 9. doi:10.3389/fpls.2021.789002(IF:5.754)
[56] Ding J, Karim H, Li Y, et al. Re-examination of the APETALA2/Ethylene-Responsive Factor Gene Family in Barley (Hordeum vulgare L.) Indicates a Role in the Regulation of Starch Synthesis. Front Plant Sci. 2021;12:791584. Published 2021 Dec 1. doi:10.3389/fpls.2021.791584(IF:5.754)
[57] Geng M, Hua Y, Liu Y, et al. Evolutionary history and functional characterization of Lj-TICAM-a and Lj-TICAM-b formed via lineage-specific tandem duplication in lamprey (Lampetra japonica). Genomics. 2021;113(4):2756-2768. doi:10.1016/j.ygeno.2021.06.022(IF:5.736)
[58] Hou F, Sun Z, Deng Y, et al. Interactome and Ubiquitinome Analyses Identify Functional Targets of Herpes Simplex Virus 1 Infected Cell Protein 0. Front Microbiol. 2022;13:856471. Published 2022 Apr 18. doi:10.3389/fmicb.2022.856471(IF:5.640)
[59] Zhou L, Ao L, Yan Y, et al. Levo-corydalmine Attenuates Vincristine-Induced Neuropathic Pain in Mice by Upregulating the Nrf2/HO-1/CO Pathway to Inhibit Connexin 43 Expression. Neurotherapeutics. 2020;17(1):340-355. doi:10.1007/s13311-019-00784-7(IF:5.552)
[60] Lei B, Liu J, Yao Z, et al. NF-κB-Induced Upregulation of miR-146a-5p Promoted Hippocampal Neuronal Oxidative Stress and Pyroptosis via TIGAR in a Model of Alzheimer's Disease. Front Cell Neurosci. 2021;15:653881. Published 2021 Apr 16. doi:10.3389/fncel.2021.653881(IF:5.505)
[61] Hsueh CY, Huang Q, Gong H, et al. A positive feed-forward loop between Fusobacteriumnucleatum and ethanol metabolism reprogramming drives laryngeal cancer progression and metastasis. iScience. 2022;25(2):103829. Published 2022 Jan 30. doi:10.1016/j.isci.2022.103829(IF:5.458)
[62] Zhang S, Xing M, Chen G, Tong L, Zhang H, Du D. Up-regulation of miR-335 and miR-674-3p in the rostral ventrolateral medulla contributes to stress-induced hypertension. J Neurochem. 2022;161(5):387-404. doi:10.1111/jnc.15589(IF:5.372)
[63] Fan Z, Yang G, Zhang W, et al. Hypoxia blocks ferroptosis of hepatocellular carcinoma via suppression of METTL14 triggered YTHDF2-dependent silencing of SLC7A11. J Cell Mol Med. 2021;25(21):10197-10212. doi:10.1111/jcmm.16957(IF:5.310)
[64] Wang W, Li T, Chen Q, Deng B, Deng L, Zeng K. Transcription Factor CsWRKY65 Participates in the Establishment of Disease Resistance of Citrus Fruits to Penicillium digitatum. J Agric Food Chem. 2021;69(20):5671-5682. doi:10.1021/acs.jafc.1c01411(IF:5.279)
[65] Jin CL, Ye M, Song ZW, et al. Lysine Interacts with Frizzled7 to Activate β-Catenin in Satellite Cell-Participated Skeletal Muscle Growth. J Agric Food Chem. 2022;70(12):3745-3756. doi:10.1021/acs.jafc.2c01027(IF:5.279)
[66] Xia H, Shen Y, Hu R, et al. Methylation of MYBA1 is Associated with the Coloration in "Manicure Finger" Grape Skin. J Agric Food Chem. 2021;69(51):15649-15659. doi:10.1021/acs.jafc.1c04550(IF:5.279)
[67] Huang Y, Zheng W, Ji C, et al. Circular RNA circRPPH1 promotes breast cancer progression via circRPPH1-miR-512-5p-STAT1 axis. Cell Death Discov. 2021;7(1):376. Published 2021 Dec 6. doi:10.1038/s41420-021-00771-y(IF:5.241)
[68] Wang X, Song H, Fang L, Wu T. EIF4A3-mediated circPRKCI expression promotes triple-negative breast cancer progression by regulating WBP2 and PI3K/AKT signaling pathway. Cell Death Discov. 2022;8(1):92. Published 2022 Mar 2. doi:10.1038/s41420-022-00892-y(IF:5.241)
[69] Chen H, Luo J, Chen S, et al. Non-drug efflux function of ABCC5 promotes enzalutamide resistance in castration-resistant prostate cancer via upregulation of P65/AR-V7. Cell Death Discov. 2022;8(1):241. Published 2022 May 3. doi:10.1038/s41420-022-00951-4(IF:5.241)
[70] Du XF, Cui HT, Pan HH, et al. Role of the miR-133a-5p/FBXO6 axis in the regulation of intervertebral disc degeneration. J Orthop Translat. 2021;29:123-133. Published 2021 Jun 19. doi:10.1016/j.jot.2021.05.004(IF:5.191)
[71] Zhou Y, Zheng R, Liu S, et al. Host E3 ligase HUWE1 attenuates the proapoptotic activity of the MERS-CoV accessory protein ORF3 by promoting its ubiquitin-dependent degradation. J Biol Chem. 2022;298(2):101584. doi:10.1016/j.jbc.2022.101584(IF:5.157)
[72] Chen S, Deng Y, Chen H, et al. Neuronal miR-138 Represses HSV-2 Lytic Infection by Regulating Viral and Host Genes with Mechanistic Differences from HSV-1. J Virol. 2022;96(9):e0034922. doi:10.1128/jvi.00349-22(IF:5.103)
[73] Wang D, Li Y, Liu Y, et al. NPM1 promotes cell proliferation by targeting PRDX6 in colorectal cancer. Int J Biochem Cell Biol. 2022;147:106233. doi:10.1016/j.biocel.2022.106233(IF:5.085)
[74] Deng Z, Zheng L, Xie X, Wei H, Peng J. GPA peptide enhances Nur77 expression in intestinal epithelial cells to exert a protective effect against DSS-induced colitis. FASEB J. 2020;34(11):15364-15378. doi:10.1096/fj.202000391RR(IF:4.966)
[75] Huang X, Sun L, Wen S, et al. RNA sequencing of plasma exosomes revealed novel functional long noncoding RNAs in hepatocellular carcinoma. Cancer Sci. 2020;111(9):3338-3349. doi:10.1111/cas.14516(IF:4.966)
[76] Wang X, Yao Z, Fang L. miR-22-3p/PGC1β Suppresses Breast Cancer Cell Tumorigenesis via PPARγ. PPAR Res. 2021;2021:6661828. Published 2021 Mar 12. doi:10.1155/2021/6661828(IF:4.964)
[77] Yu MC, Ding GY, Ma P, et al. CircRNA UBAP2 serves as a sponge of miR-1294 to increase tumorigenesis in hepatocellular carcinoma through regulating c-Myc expression. Carcinogenesis. 2021;42(10):1293-1303. doi:10.1093/carcin/bgab068(IF:4.944)
[78] Wang Q, Ren D, Bi Y, et al. Association and functional study between ADIPOQ and metabolic syndrome in elderly Chinese Han population. Aging (Albany NY). 2020;12(24):25819-25827. doi:10.18632/aging.104203(IF:4.831)
[79] Yuan J, Li X, Zhang G, et al. USP39 mediates p21-dependent proliferation and neoplasia of colon cancer cells by regulating the p53/p21/CDC2/cyclin B1 axis. Mol Carcinog. 2021;60(4):265-278. doi:10.1002/mc.23290(IF:4.784)
[80] Tang Y, Wang L, Qu Z, et al. BSISTER transcription factors directly binds to the promoter of IAA19 and IAA29 genes to up-regulate gene expression and promote the root development. Plant Sci. 2022;321:111324. doi:10.1016/j.plantsci.2022.111324(IF:4.729)
[81] Li D, Liu B, Wang Z, et al. Sugar accumulation may be regulated by a transcriptional cascade of ABA-VvGRIP55-VvMYB15-VvSWEET15 in grape berries under root restriction. Plant Sci. 2022;322:111288. doi:10.1016/j.plantsci.2022.111288(IF:4.729)
[82] Gan Z, Yuan X, Shan N, et al. AcWRKY40 mediates ethylene biosynthesis during postharvest ripening in kiwifruit. Plant Sci. 2021;309:110948. doi:10.1016/j.plantsci.2021.110948(IF:4.729)
[83] Bai HL, Kang CM, Sun ZQ, et al. TTDA inhibited apoptosis by regulating the p53-Bax/Bcl2 axis in glioma. Exp Neurol. 2020;331:113380. doi:10.1016/j.expneurol.2020.113380(IF:4.691)
[84] Zhang H, Hu Y, Gu B, Cui X, Zhang J. VaMYB44 transcription factor from Chinese wild Vitis amurensis negatively regulates cold tolerance in transgenic Arabidopsis thaliana and V. vinifera. Plant Cell Rep. 2022;41(8):1673-1691. doi:10.1007/s00299-022-02883-w(IF:4.570)
[85] Sun W, Zu S, Shao G, Wang W, Gong F. Long non-coding DANCR targets miR-185-5p to upregulate LIM and SH3 protein 1 promoting prostate cancer via the FAK/PI3K/AKT/GSK3β/snail pathway. J Gene Med. 2021;23(7):e3344. doi:10.1002/jgm.3344(IF:4.565)
[86] Luo SY, Wang JQ, Liu C, et al. Hif-1α/Hsf1/Hsp70 signaling pathway regulates redox homeostasis and apoptosis in large yellow croaker ( Larimichthys crocea) under environmental hypoxia. Zool Res. 2021;42(6):746-760. doi:10.24272/j.issn.2095-8137.2021.224(IF:4.560)
[87] Liu J, Zhu M, Tang Q. Human umbilical cord mesenchymal stem cells-derived exosomal microRNA-181a retards nasopharyngeal carcinoma development by mediating KDM5C. J Cancer Res Clin Oncol. 2021;147(10):2867-2877. doi:10.1007/s00432-021-03684-6(IF:4.553)
[88] Huang Y, Wan S, Yang M. Circ_0067680 expedites the osteogenic differentiation of human bone marrow-derived mesenchymal stem cells through miR-4429/CTNNB1/Wnt/β-catenin pathway. Biol Direct. 2021;16(1):16. Published 2021 Oct 14. doi:10.1186/s13062-021-00302-w(IF:4.540)
[89] Wang B, Cai Y, Li X, Kong Y, Fu H, Zhou J. ETV4 mediated lncRNA C2CD4D-AS1 overexpression contributes to the malignant phenotype of lung adenocarcinoma cells via miR-3681-3p/NEK2 axis. Cell Cycle. 2021;20(24):2607-2618. doi:10.1080/15384101.2021.2005273(IF:4.534)
[90] Geng S, Tu S, Fu W, Wang J, Bai Z. LncRNA PITPNA-AS1 stimulates cell proliferation and suppresses cell apoptosis in glioblastoma via targeting miR-223-3p/EGFR axis and activating PI3K/AKT signaling pathway. Cell Cycle. 2021;20(19):1988-1998. doi:10.1080/15384101.2021.1958503(IF:4.534)
[91] Ma X, Li C, Yuan Y, Zhao M, Li J. Xyloglucan endotransglucosylase/hydrolase genes LcXTH4/7/19 are involved in fruitlet abscission and are activated by LcEIL2/3 in litchi. Physiol Plant. 2021;173(3):1136-1146. doi:10.1111/ppl.13509(IF:4.500)
[92] Zhang L, Ouyang P, He G, et al. Exosomes from microRNA-126 overexpressing mesenchymal stem cells promote angiogenesis by targeting the PIK3R2-mediated PI3K/Akt signalling pathway. J Cell Mol Med. 2021;25(4):2148-2162. doi:10.1111/jcmm.16192(IF:4.486)
[93] Chen N, Ma B, Guo S, Yin B, Zhang J, Deng G. microRNA-196b alleviates lipopolysaccharide-induced inflammatory injury by targeting NRAS. Mol Immunol. 2022;147:10-20. doi:10.1016/j.molimm.2022.03.122(IF:4.407)
[94] Zhang Y, Wang X, Huang X, et al. Transcriptome sequencing profiling identifies miRNA-331-3p as an osteoblast-specific miRNA in infected bone nonunion. Bone. 2021;143:115619. doi:10.1016/j.bone.2020.115619(IF:4.398)
[95] Zhou YM, Yao YL, Liu W, Shen XM, Shi LJ, Wu L. MicroRNA-134 inhibits tumor stem cell migration and invasion in oral squamous cell carcinomas via downregulation of PI3K-Akt signaling pathway by inhibiting LAMC2 expression. Cancer Biomark. 2020;29(1):51-67. doi:10.3233/CBM-191362(IF:4.388)
[96] Ma Y, Luo Q, Ou Y, et al. New insights into the proteins interacting with the promoters of silkworm fibroin genes. Sci Rep. 2021;11(1):15880. Published 2021 Aug 5. doi:10.1038/s41598-021-95400-0(IF:4.380)
[97] Zhu M, Li X, Sun R, et al. The C/EBPβ-Dependent Induction of TFDP2 Facilitates Porcine Reproductive and Respiratory Syndrome Virus Proliferation. Virol Sin. 2021;36(6):1341-1351. doi:10.1007/s12250-021-00403-w(IF:4.327)
[98] Yin Q, Wang J, Fu Q, Gu S, Rui Y. CircRUNX2 through has-miR-203 regulates RUNX2 to prevent osteoporosis. J Cell Mol Med. 2018;22(12):6112-6121. doi:10.1111/jcmm.13888(IF:4.302)
[99] Gao L, Liu J, Xu P, et al. AKT Inhibitor SC66 Inhibits Proliferation and Induces Apoptosis in Human Glioblastoma Through Down-Regulating AKT/β-Catenin Pathway. Front Pharmacol. 2020;11:1102. Published 2020 Jul 31. doi:10.3389/fphar.2020.01102(IF:4.225)
[100] Shan N, Zhang Y, Xu Y, et al. Ethylene-induced potassium transporter AcKUP2 gene is involved in kiwifruit postharvest ripening. BMC Plant Biol. 2022;22(1):108. Published 2022 Mar 9. doi:10.1186/s12870-022-03498-9(IF:4.215)
[101] Cao Y, Bi M, Yang P, et al. Construction of yeast one-hybrid library and screening of transcription factors regulating LhMYBSPLATTER expression in Asiatic hybrid lilies (Lilium spp.). BMC Plant Biol. 2021;21(1):563. Published 2021 Nov 29. doi:10.1186/s12870-021-03347-1(IF:4.215)
[102] Ma J, Zhang X, Zhang H, Chen H. lncRNA MEG3 Suppresses the Progression of Ankylosis Spondylitis by Regulating the Let-7i/SOST Axis. Front Mol Biosci. 2020;7:173. Published 2020 Jul 24. doi:10.3389/fmolb.2020.00173(IF:4.188)
[103] Anwar M, Yu W, Yao H, Zhou P, Allan AC, Zeng L. NtMYB3, an R2R3-MYB from Narcissus, Regulates Flavonoid Biosynthesis. Int J Mol Sci. 2019;20(21):5456. Published 2019 Nov 1. doi:10.3390/ijms20215456(IF:4.183)
[104] Xu W, Chen B, Ke D, Chen X. MicroRNA-138-5p targets the NFIB-Snail1 axis to inhibit colorectal cancer cell migration and chemoresistance [published correction appears in Cancer Cell Int. 2020 Nov 3;20(1):533]. Cancer Cell Int. 2020;20:475. Published 2020 Oct 1. doi:10.1186/s12935-020-01573-5(IF:4.175)
[105] Tian C, Hu S, Yu J, Li W, Li P, Huang H. CREB1 transcription-activated lncRNA PVT1 promotes cardiac fibrosis via miR-145/HCN1 axis. Int J Cardiol. 2022;353:88-95. doi:10.1016/j.ijcard.2022.01.024(IF:4.164)
[106] Zhou Y, Zhu Y, Dong X, et al. Exosomes Derived from Pancreatic Cancer Cells Induce Osteoclast Differentiation Through the miR125a-5p/TNFRSF1B Pathway. Onco Targets Ther. 2021;14:2727-2739. Published 2021 Apr 19. doi:10.2147/OTT.S282319(IF:4.147)
[107] Zhu Y, Li P, Dan X, Kang X, Ma Y, Shi Y. miR-377 Inhibits Proliferation and Differentiation of Bovine Skeletal Muscle Satellite Cells by Targeting FHL2. Genes (Basel). 2022;13(6):947. Published 2022 May 26. doi:10.3390/genes13060947(IF:4.096)
[108] Bu X, Zhao Y, Chang M, Ge X. Downregulation of lncRNA SNHG14 alleviates neurons injury by modulating the miR-181c-5p/BMF axis in ischemic stroke. Brain Res Bull. 2021;174:379-388. doi:10.1016/j.brainresbull.2021.06.026(IF:4.079)
[109] Guo H, Jiang Y, Gu Z, et al. ZFP36 protects against oxygen-glucose deprivation/reoxygenation-induced mitochondrial fragmentation and neuronal apoptosis through inhibiting NOX4-DRP1 pathway. Brain Res Bull. 2022;179:57-67. doi:10.1016/j.brainresbull.2021.12.003(IF:4.079)
[110] Yang L, Liu Z, Ma J, et al. CircRPPH1 serves as a sponge for miR-296-5p to enhance progression of breast cancer by regulating FOXP4 expression. Am J Transl Res. 2021;13(7):7556-7573. Published 2021 Jul 15. (IF:4.060)
[111] Gao G, Li X, Zhang J, Yu H. YY1 as a promoter regulating the circ_0001946/miR-671-5p/EGFR axis to promote chemotherapy resistance in breast cancer cells. Am J Transl Res. 2022;14(4):2550-2566. Published 2022 Apr 15. (IF:4.060)
[112] Xiao E, Zhang D, Zhan W, et al. circNFIX facilitates hepatocellular carcinoma progression by targeting miR-3064-5p/HMGA2 to enhance glutaminolysis. Am J Transl Res. 2021;13(8):8697-8710. Published 2021 Aug 15. (IF:4.060)
[113] Wang H, Song X, Song C, Wang X, Cao H. m6A-seq analysis of microRNAs reveals that the N6-methyladenosine modification of miR-21-5p affects its target expression. Arch Biochem Biophys. 2021;711:109023. doi:10.1016/j.abb.2021.109023(IF:4.013)
[114] Huang Y, Wu P, Zheng J, Qiu L. Identification of cis-acting elements in response to fenvalerate in the CYP6B7 promoter of Helicoverpa armigera. Pestic Biochem Physiol. 2022;183:105060. doi:10.1016/j.pestbp.2022.105060(IF:3.963)
[115] Li X, Wang N, She W, et al. Identification and Functional Analysis of the CgNAC043 Gene Involved in Lignin Synthesis from Citrusgrandis "San Hong". Plants (Basel). 2022;11(3):403. Published 2022 Jan 31. doi:10.3390/plants11030403(IF:3.935)
[116] Wu Y, Zhang M, Bi X, Hao L, Liu R, Zhang H. JPR1 mediated circ_0004018 suppresses angiogenesis in hepatocellular carcinoma via recruiting FUS and stabilizing TIMP2 expression. Exp Cell Res. 2021;408(2):112804. doi:10.1016/j.yexcr.2021.112804(IF:3.905)
[117] Luo E, Wang D, Yan G, et al. The NF-κB/miR-425-5p/MCT4 axis: A novel insight into diabetes-induced endothelial dysfunction. Mol Cell Endocrinol. 2020;500:110641. doi:10.1016/j.mce.2019.110641(IF:3.693)
[118] Zhang C, Wang Q, Liu AQ, et al. MicroRNA miR-155 inhibits cyprinid herpesvirus 3 replication via regulating AMPK-MAVS-IFN axis. Dev Comp Immunol. 2022;129:104335. doi:10.1016/j.dci.2021.104335(IF:3.636)
[119] Zhang G, Li G, Xiang Y, Zhang A. The transcription factor ZmMYB-CC10 improves drought tolerance by activating ZmAPX4 expression in maize. Biochem Biophys Res Commun. 2022;604:1-7. doi:10.1016/j.bbrc.2022.02.051(IF:3.575)
[120] Han T, Yan J, Xiang Y, Zhang A. Phosphorylation of ZmNAC84 at Ser-113 enhances the drought tolerance by directly modulating ZmSOD2 expression in maize. Biochem Biophys Res Commun. 2021;567:86-91. doi:10.1016/j.bbrc.2021.06.026(IF:3.575)
[121] Jiang H, Guo W, Yuan S, Song L. PLOD1 Is a Prognostic Biomarker and Mediator of Proliferation and Invasion in Osteosarcoma. Biomed Res Int. 2020;2020:3418398. Published 2020 Oct 19. doi:10.1155/2020/3418398(IF:3.411)
[122] Li Z, Chen Z, Feng Y, Hu G, Jiang Y. CircMMP11 acts as a ce-circRNA in breast cancer progression by regulating miR-1204. Am J Transl Res. 2020;12(6):2585-2599. Published 2020 Jun 15. (IF:3.375)
[123] Ma H, Liu T, Xu Y, Wang X, Wang J, Liu X. MiR-519d and miR-328-3p Combinatorially Suppress Breast Cancer Progression. Onco Targets Ther. 2020;13:12987-12997. Published 2020 Dec 18. doi:10.2147/OTT.S281962(IF:3.337)
[124] Chu P, He L, Zhu D, et al. Identification, expression and functional characterisation of CYP1A in grass carp (Ctenopharyngodon idella). Fish Shellfish Immunol. 2019;95:35-43. doi:10.1016/j.fsi.2019.10.022(IF:3.298)
[125] Yin D, Shao Y, Yang K, et al. Fowl adenovirus serotype 4 uses gga-miR-181a-5p expression to facilitate viral replication via targeting of STING. Vet Microbiol. 2021;263:109276. doi:10.1016/j.vetmic.2021.109276(IF:3.293)
[126] Abudurexiti M, Zhu W, Wang Y, et al. Targeting CPT1B as a potential therapeutic strategy in castration-resistant and enzalutamide-resistant prostate cancer. Prostate. 2020;80(12):950-961. doi:10.1002/pros.24027(IF:3.279)
[127] Meng J, Song X, Yan G, Wang H, Li H, Lou D. Dendrobine suppresses endoplasmic reticulum stress-induced apoptosis through upregulating microRNA miR-381-3p to decrease caspase-4. Bioengineered. 2021;12(1):4452-4463. doi:10.1080/21655979.2021.1956672(IF:3.269)
[128] Zhou Y, Pan A, Zhang Y, Li X. Hsa_circ_0039569 facilitates the progression of endometrial carcinoma by targeting the miR-197/high mobility group protein A1 axis. Bioengineered. 2022;13(2):4212-4225. doi:10.1080/21655979.2022.2027060(IF:3.269)
[129] Zhang Y, Yu Y, Cao X, Chen P. Role of lncRNA FAM83H antisense RNA1 (FAM83H-AS1) in the progression of non-small cell lung cancer by regulating the miR-545-3p/heparan sulfate 6-O-sulfotransferase (HS6ST2) axis. Bioengineered. 2022;13(3):6476-6489. doi:10.1080/21655979.2022.2031668(IF:3.269)
[130] Wu W, Wang L, Li S. Hox transcript antisense RNA knockdown inhibits osteosarcoma progression by regulating the phosphoinositide 3-kinase/AKT pathway through the microRNA miR-6888-3p/spleen tyrosine kinase axis. Bioengineered. 2022;13(4):9397-9410. doi:10.1080/21655979.2022.2059614(IF:3.269)
[131] Ge Z, Liu H, Ji T, et al. Long non-coding RNA 00960 promoted the aggressiveness of lung adenocarcinoma via the miR-124a/SphK1 axis. Bioengineered. 2022;13(1):1276-1287. doi:10.1080/21655979.2021.1996507(IF:3.269)
[132] Hao W, Lin F, Shi H, Guan Z, Jiang Y. Long non-coding RNA OIP5-AS1 regulates smoke-related chronic obstructive pulmonary disease via targeting micro RNA -410-3p/IL-13. Bioengineered. 2021;12(2):11664-11676. doi:10.1080/21655979.2021.2000199(IF:3.269)
[133] Shuang Y, Liu J, Niu J, Guo W, Li C. A novel circular RNA circPPFIA1 promotes laryngeal squamous cell carcinoma progression through sponging miR-340-3p and regulating ELK1 expression. Bioengineered. 2021;12(1):5220-5230. doi:10.1080/21655979.2021.1959866(IF:3.269)
[134] Zhou H, Jia X, Yang F, Shi P. miR-148a-3p suppresses the progression of acute myeloid leukemia via targeting cyclin-dependent kinase 6 (CDK6). Bioengineered. 2021;12(1):4508-4519. doi:10.1080/21655979.2021.1956400(IF:3.269)
[135] Mao K, Jin R, Ren Z, et al. miRNAs targeting CYP6ER1 and CarE1 are involved in nitenpyram resistance in Nilaparvata lugens. Insect Sci. 2022;29(1):177-187. doi:10.1111/1744-7917.12910(IF:3.262)
[136] Zhang W, Qin P, Gong X, et al. Identification of circRNAs in the Liver of Whitespotted Bamboo Shark (Chiloscyllium plagiosum). Front Genet. 2020;11:596308. Published 2020 Dec 11. doi:10.3389/fgene.2020.596308(IF:3.260)
[137] Xie D, Li S, Wu T, Wang X, Fang L. MiR-181c suppresses triple-negative breast cancer tumorigenesis by targeting MAP4K4. Pathol Res Pract. 2022;230:153763. doi:10.1016/j.prp.2022.153763(IF:3.250)
[138] Jia A, Yang ZW, Shi JY, Liu JM, Zhang K, Cui YF. MiR-325-3p Alleviates Acute Pancreatitis via Targeting RIPK3 [published online ahead of print, 2022 Jan 30]. Dig Dis Sci. 2022;10.1007/s10620-021-07322-6. doi:10.1007/s10620-021-07322-6(IF:3.199)
[139] Li M, Noshay JM, Dong X, Springer NM, Li Q. A capture-based assay for detection and characterization of transposon polymorphisms in maize [published online ahead of print, 2021 Apr 26]. G3 (Bethesda). 2021;11(7):jkab138. doi:10.1093/g3journal/jkab138(IF:3.154)
[140] Wu W, Duan C, Lv H, et al. MiR-let-7d-3p inhibits granulosa cell proliferation by targeting TLR4 in polycystic ovary syndrome. Reprod Toxicol. 2021;106:61-68. doi:10.1016/j.reprotox.2021.10.003(IF:3.143)
[141] Yu L, Ren Y. Long Noncoding RNA Small Nucleolar RNA Host Gene 3 Mediates Prostate Cancer Migration, Invasion, and Epithelial-Mesenchymal Transition by Sponging miR-487a-3p to Regulate TRIM25 [published online ahead of print, 2021 Jan 7]. Cancer Biother Radiopharm. 2021;10.1089/cbr.2020.3988. doi:10.1089/cbr.2020.3988(IF:3.099)
[142] Ye M, Ma J, Liu B, Liu X, Ma D, Dong K. Linc01105 acts as an oncogene in the development of neuroblastoma [published correction appears in Oncol Rep. 2021 Sep;46(3):]. Oncol Rep. 2019;42(4):1527-1538. doi:10.3892/or.2019.7257(IF:3.041)
[143] Huo W, Wang Y, Chen T, et al. Triclosan activates c-Jun/miR-218-1-3p/SLC35C1 signaling to regulate cell viability, migration, invasion and inflammatory response of trophoblast cells in vitro. BMC Pregnancy Childbirth. 2022;22(1):470. Published 2022 Jun 6. doi:10.1186/s12884-022-04791-z(IF:3.007)
[144] Dong L, Wang M, Gao X, et al. miR-9-5p promotes myogenic differentiation via the Dlx3/Myf5 axis. PeerJ. 2022;10:e13360. Published 2022 May 3. doi:10.7717/peerj.13360(IF:2.984)
[145] Chen J, Shi P, Zhang J, et al. CircRNA_0044556 diminishes the sensitivity of triple‑negative breast cancer cells to adriamycin by sponging miR‑145 and regulating NRAS. Mol Med Rep. 2022;25(2):51. doi:10.3892/mmr.2021.12567(IF:2.952)
[146] Ding X, Deng G, Liu J, et al. GOLM1 silencing inhibits the proliferation and motility of human glioblastoma cells via the Wnt/β-catenin signaling pathway. Brain Res. 2019;1717:117-126. doi:10.1016/j.brainres.2019.03.035(IF:2.929)
[147] Yang F, Chen R. Loss of PHLDA1 has a protective role in OGD/R-injured neurons via regulation of the GSK-3β/Nrf2 pathway. Hum Exp Toxicol. 2021;40(11):1909-1920. doi:10.1177/09603271211014596(IF:2.903)
[148] Wang L, Zhang L, Wang L. SNHG7 Contributes to the Progression of Non-Small-Cell Lung Cancer via the SNHG7/miR-181a-5p/E2F7 Axis. Cancer Manag Res. 2020;12:3211-3222. Published 2020 May 7. doi:10.2147/CMAR.S240964(IF:2.886)
[149] Tian Y, Guan Y, Su Y, Luo W, Yang G, Zhang Y. MiR-582-5p Inhibits Bladder Cancer-Genesis by Suppressing TTK Expression. Cancer Manag Res. 2020;12:11933-11944. Published 2020 Nov 20. doi:10.2147/CMAR.S274835(IF:2.886)
[150] Xia L, Shen D, Wang H, Ren L, Chen Y, Li G. Identification of Small-Molecule Regulators of Testicular Receptor 4 via a Drug Repurposing Screening. ACS Omega. 2020;5(47):30625-30632. Published 2020 Nov 19. doi:10.1021/acsomega.0c04623(IF:2.870)
[151] Cao Y, Zhang F, Wang H, et al. LncRNA MALAT1 mediates doxorubicin resistance of hepatocellular carcinoma by regulating miR-3129-5p/Nova1 axis. Mol Cell Biochem. 2021;476(1):279-292. doi:10.1007/s11010-020-03904-6(IF:2.795)
[152] Ding X, Sun J, Zhang X. Circ_0076305 facilitates prostate cancer development via sponging miR-411-5p and regulating PGK1. Andrologia. 2022;54(6):e14406. doi:10.1111/and.14406(IF:2.775)
[153] Yang F, Chen R. Sestrin1 exerts a cytoprotective role against oxygen-glucose deprivation/reoxygenation-induced neuronal injury by potentiating Nrf2 activation via the modulation of Keap1. Brain Res. 2021;1750:147165. doi:10.1016/j.brainres.2020.147165(IF:2.733)
[154] Zhang Z. MiR-124-3p Suppresses Prostatic Carcinoma by Targeting PTGS2 Through the AKT/NF-κB Pathway. Mol Biotechnol. 2021;63(7):621-630. doi:10.1007/s12033-021-00326-7(IF:2.695)
[155] Jin S, He J, Li J, Guo R, Shu Y, Liu P. MiR-873 inhibition enhances gefitinib resistance in non-small cell lung cancer cells by targeting glioma-associated oncogene homolog 1. Thorac Cancer. 2018;9(10):1262-1270. doi:10.1111/1759-7714.12830(IF:2.569)
[156] Zhang J, Xu X, Wang M. Clinical significance of serum miR-101-3p expression in patients with neonatal sepsis. Per Med. 2021;18(6):541-550. doi:10.2217/pme-2020-0182(IF:2.512)
[157] Shi Z, He J, He J, Xu Y. Micro-fragmented adipose tissue regulated the biological functions of osteoarthritis synoviocytes by upregulating MiR-92a-3p expression. Tissue Cell. 2022;74:101716. doi:10.1016/j.tice.2021.101716(IF:2.466)
[158] Huang J, Qin Y, Lin C, Huang X, Zhang F. MTHFD2 facilitates breast cancer cell proliferation via the AKT signaling pathway. Exp Ther Med. 2021;22(1):703. doi:10.3892/etm.2021.10135(IF:2.447)
[159] Shi F, Yang Q, Shen D, Chen J. CircRNA WHSC1 promotes non-small cell lung cancer progression via sponging microRNA-296-3p and up-regulating expression of AKT serine/threonine kinase 3. J Clin Lab Anal. 2021;35(8):e23865. doi:10.1002/jcla.23865(IF:2.352)
[160] Wang K, Li M, Zhang T, Xu C, Yu F, Duan H. LINC01116 Facilitates Melanoma 1 Progression Via Sequestering miR-3612 and Up-regulating GDF11 and SDC3. Arch Med Res. 2022;53(1):44-50. doi:10.1016/j.arcmed.2021.06.008(IF:2.235)
[161] Wang L, Zhang J. Long intergenic ncRNA 00473 improves the invasion of trophoblastic cells via miR-16-5p. Pregnancy Hypertens. 2021;23:174-184. doi:10.1016/j.preghy.2020.12.003(IF:2.095)
[162] Li K, Zhou Z, Li J, Xiang R. miR-146b Functions as an Oncogene in Oral Squamous Cell Carcinoma by Targeting HBP1. Technol Cancer Res Treat. 2020;19:1533033820959404. doi:10.1177/1533033820959404(IF:2.074)
[163] Xu W, Sun D, Wang Y, et al. Inhibitory effect of microRNA-608 on lung cancer cell proliferation, migration, and invasion by targeting BRD4 through the JAK2/STAT3 pathway. Bosn J Basic Med Sci. 2020;20(3):347-356. Published 2020 Aug 3. doi:10.17305/bjbms.2019.4216(IF:2.050)
[164] Li Y, Liu L. LncRNA OIP5-AS1 Signatures as a Biomarker of Gestational Diabetes Mellitus and a Regulator on Trophoblast Cells. Gynecol Obstet Invest. 2021;86(6):509-517. doi:10.1159/000520340(IF:2.031)
[165] Li Y, Liu Y, Zhang J, Li J, Shu Y. Propofol Suppresses Glioma Tumorigenesis by Regulating circ_0047688/miR-516b-5p/IFI30 Axis [published online ahead of print, 2022 Jun 28]. Biochem Genet. 2022;10.1007/s10528-022-10243-2. doi:10.1007/s10528-022-10243-2(IF:1.890)
[166] Zheng Q, Yu JJ, Li C, Li J, Wang J, Wang S. miR-224 targets BTRC and promotes cell migration and invasion in colorectal cancer. 3 Biotech. 2020;10(11):485. doi:10.1007/s13205-020-02477-x(IF:1.798)
[167] Chen Y, Niu K, Song Q, Feng Q. Effect of G-quadruplex loop mutations on the G-quadruplex formation, protein binding and transcription of BmPOUM2 in Bombyx mori. Arch Insect Biochem Physiol. 2022;110(1):e21876. doi:10.1002/arch.21876(IF:1.698)
[168] Wang Z, Chen R, Xu Z, et al. MiR-155-5p promotes renal interstitial fibrosis in obstructive nephropathy via inhibiting SIRT1 signaling pathway. J Recept Signal Transduct Res. 2021;41(5):466-475. doi:10.1080/10799893.2020.1825491(IF:1.466)
[169] Zhou Y, Zhang F, Xu F, et al. lncRNA NEAT1 regulates CYP1A2 and influences steroid-induced necrosis. Open Life Sci. 2021;16(1):969-980. Published 2021 Sep 13. doi:10.1515/biol-2021-0097(IF:0.938)