细胞培养上清外泌体快速抽提试剂盒|Quick exosome isolation Kit(for Cell Culture Media)
产品说明书
FAQ
COA
已发表文献
产品描述
Exosome(外泌体)是由活细胞分泌的直径约为30-150 nm的小囊泡,具有典型的脂质双分子层结构;存在于细胞培养上清液、血清、血浆、唾液、尿液、羊水以及其它生物体液中;Exosome携带有多种蛋白质、脂类、DNA和RNA等重要信息,不仅在细胞与细胞间的物质和信息传递中起重要作用,更有望成为多种疾病的早期诊断标志物。
本试剂盒采用独特的分离技术,可以快速从细胞培养上清中获得大量完整的外泌体颗粒,适用于下游的细胞共培养、电镜分析、Western Blot、荧光定量(qPCR)和高通量测序等应用。
产品组分
|
编号 |
组分 |
产品编号/规格 |
|
|
41201JP25 |
41201JP50 |
||
|
41201-A |
Exosome isolation solution( Cell Culture Media) |
25 mL |
50 mL |
运输和保存方法
室温运输,本试剂盒可于室温稳定保存24个月。
注意事项
1)为了确保获得的外泌体是来自于您的细胞,最好使用无外泌体的血清进行培养。
2)如果想要进一步纯化外泌体,可以使用相应抗体包被的磁珠进行亲和纯化。
3)产品只针对细胞培养上清来源的外泌体分离,不适用血清/血浆中外泌体的抽提,如果需要进行血清/血浆的外泌体分离,请选用血清/血浆外泌体快速抽提试剂盒。
4)为了您的安全和健康,请穿实验服并戴一次性手套操作。
5)本产品仅作科研用途!
操作方法
样品制备:
收集细胞培养基至15 mL离心管中,3000×g,离心10 min;小心收集上清,并转移至新的离心管中(勿破坏沉淀),于冰上放置待用。
注:若收集的细胞上清不能及时使用,可先放置于-20℃或-80℃冷冻。使用时,于25℃水浴锅中解冻,完全溶解后置于冰上待用。
外泌体分离:
1)试剂准备:使用前请将外泌体抽提试剂充分混匀。
2)上清预处理:吸取10 mL的细胞培养上清,加入2.5 mL外泌体抽提试剂(41201-A),涡旋振荡混匀1 min,再放置于2℃至8℃静置2h;
|
细胞培养上清 |
外泌体抽提试剂 |
用途 |
|
10 mL |
2.5 mL |
电镜、NTA粒径、Western Blot |
|
40 mL |
10 mL |
多基因核酸分析(qPCR)、测序 |
注:上述用量的推荐,仅针对外泌体分泌量高的肿瘤细胞,对于外泌体分泌量少的样品(例如干细胞)可以适当加大上清的用量。其它规格的细胞上清可以根据外泌体抽提试剂的用量进行等比例换算。
3)外泌体沉淀:取出装有混合液的离心管于4℃,10000×g离心60 min,弃上清,收集沉淀(尽可能吸尽上清)。
4)外泌体重悬:取100 μL 1×PBS均匀吹打离心沉淀物,使其充分混匀,并转移至新的1.5 mL离心管中;
注:外泌体颗粒会附着在管壁上,重悬时可以使用PBS对管壁进行反复吹打洗脱(避免剧烈吹打)。重悬用的PBS的量可以根据细胞上清的量进行等比例增加,也可以根据可能获得的外泌体的量进行适当的增加或者减少。
5)外泌体的洗涤:将含有外泌体的1.5mL离心管于4℃,12000×g离心2 min,弃沉淀,保留上清液。
6)外泌体的保存:纯化后的外泌体可于4℃保存3天,-80℃ 长期保存,避免反复冻融。
外泌体浓缩(可选):
如果获得的外泌体浓度比较低,可以使用密理博3kD孔径的超滤管于4℃,14000×g离心10-30 min,内管中即为纯化后的外泌体颗粒。
外泌体除菌(可选):
获得的外泌体后期需要与细胞共培养,可以使用0.22 μm的滤器进行过滤除菌。初次尝试时,建议外泌体蛋白浓度在10-100 μg/mL内做梯度摸索,选择一个较为合适的条件。
结果展示:
|
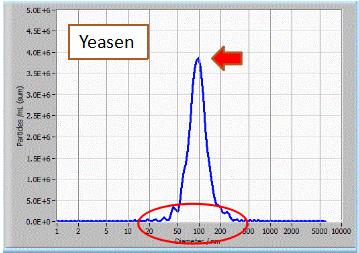
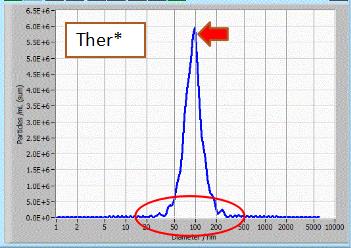
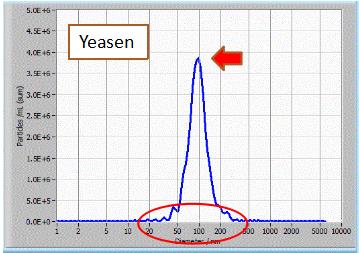
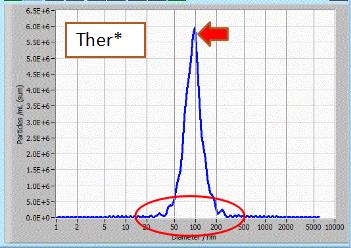
NTA粒径检测:结果显示通过Yeasen外泌体抽提获得的外泌体分散性好,大小均一,峰形单一。 |
|
|
|
样品来源:293T细胞培养上清。 检测仪器:ZetaView 上清用量:10 mL |
|
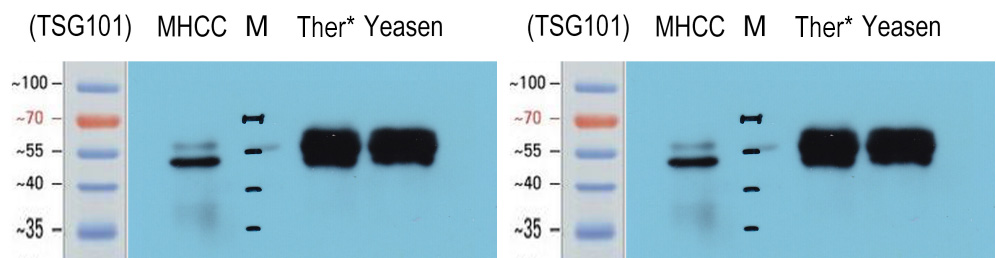
表面标志物分析:通过Western Blot分析外泌体表面蛋白,可以很好的检测到TSG101,CD63和MHCC的存在。 |
|
|
|
样品来源:293T细胞培养上清。 裂解方式:RIPA裂解液 上清用量:10 mL |
|
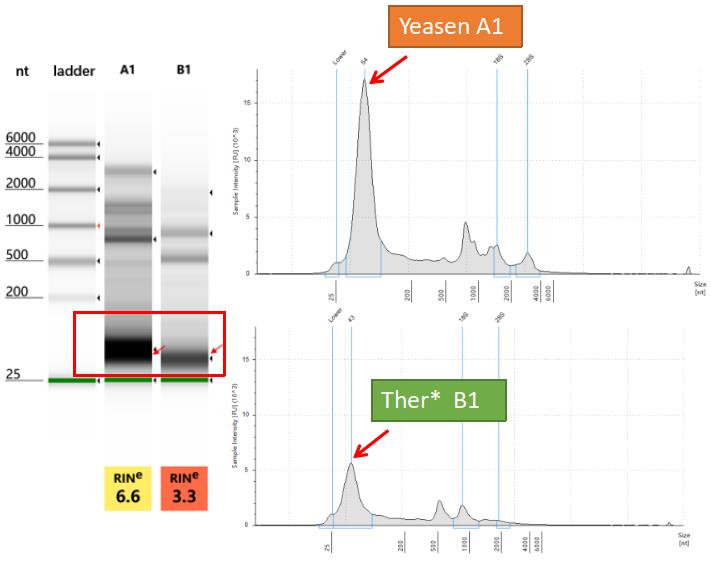
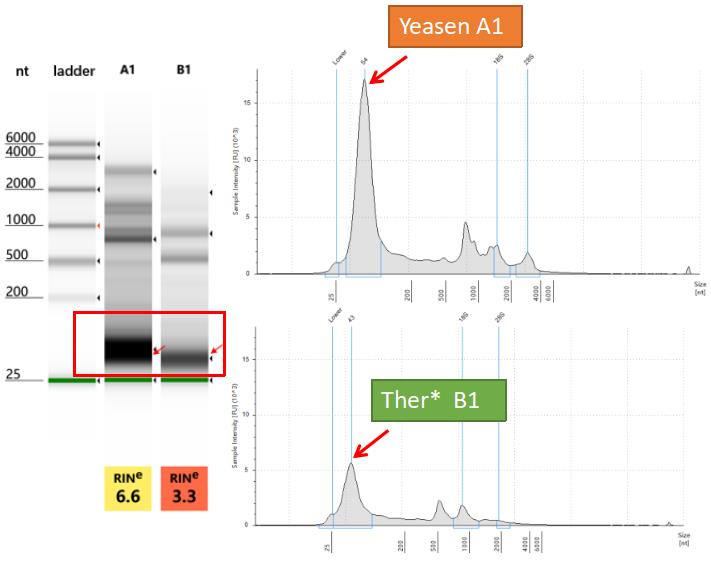
核酸分析:通过Agilent 4200分析,可以检测到较为明显的外泌体小RNA条带,足以满足下游高通量测序的需求。 |
|
|
|
样品来源:293T细胞培养上清。 检测仪器:Agilent 4200 抽提方法:Trizol 上清用量:40 mL |
相关产品推荐
|
货号 |
名称 |
规格 |
|
|
外泌体分离 |
41202JP30 |
Hieff® Quick exosome isolation kit(for Serum/Plasma) 血清/血浆外泌体快速抽提试剂盒 |
30 mL |
|
外泌体定量 |
20118JP60 |
Lysis Buffer for WB/IP Assays 免疫印迹及免疫沉淀用(WB/IP)裂解液 |
100 mL |
|
20201JP76 |
BCA Protein Quantification Kit BCA 蛋白浓度测定试剂盒(增强型) |
500 T(100 mL) |
|
|
外泌体鉴定 (Western Blot) |
36231JP10 |
Precast Protein Improve Gels, 4%-20%, 15 wells 4%-20%高分辨率梯度预制胶,15孔 |
1盒(10块) |
|
36232JP10 |
Precast Protein Improve Gels,, 8%, 10 wells 8% 高分辨率梯度预制胶,10孔 |
1盒(10块) |
|
|
36233JP10 |
Precast Protein Improve Gels,, 10%, 10 wells 10%高分辨率梯度预制胶,10孔 |
1盒(10块) |
|
|
36234JP10 |
Precast Protein Improve Gels,, 12%, 10 wells 12%高分辨率梯度预制胶,10孔 |
1盒(10块) |
|
|
36235JP10 |
Precast Protein Improve Gels,, 15%, 10 wells 15%高分辨率梯度预制胶,10孔 |
1盒(10块) |
|
|
20351JP76 |
GoldBand 3-color Regular Range Protein Marker(10-180 kDa)三色预染蛋白质分子量标准 |
2×250 μL |
|
|
20352JP76 |
GoldBand 3-color High Range Protein Marker(10-245kDa) 三色预染蛋白质分子量标准 |
2×250 μL |
|
|
外泌体标记 |
40726JP10 |
DiI (DiIC18(3)) 细胞膜橙红色荧光探针 |
10 mg |
|
40757JP25 |
DiR Iodide (DiIC18(7)) 细胞膜深红色荧光探针 |
25 mg |
详情请咨询:021-50837765
HB180517
产品描述
Exosome(外泌体)是由活细胞分泌的直径约为30-150 nm的小囊泡,具有典型的脂质双分子层结构;存在于细胞培养上清液、血清、血浆、唾液、尿液、羊水以及其它生物体液中;Exosome携带有多种蛋白质、脂类、DNA和RNA等重要信息,不仅在细胞与细胞间的物质和信息传递中起重要作用,更有望成为多种疾病的早期诊断标志物。
本试剂盒采用独特的分离技术,可以快速从细胞培养上清中获得大量完整的外泌体颗粒,适用于下游的细胞共培养、电镜分析、Western Blot、荧光定量(qPCR)和高通量测序等应用。
产品组分
|
编号 |
组分 |
产品编号/规格 |
|
|
41201JP25 |
41201JP50 |
||
|
41201-A |
Exosome isolation solution( Cell Culture Media) |
25 mL |
50 mL |
运输和保存方法
室温运输,本试剂盒可于室温稳定保存24个月。
注意事项
1)为了确保获得的外泌体是来自于您的细胞,最好使用无外泌体的血清进行培养。
2)如果想要进一步纯化外泌体,可以使用相应抗体包被的磁珠进行亲和纯化。
3)产品只针对细胞培养上清来源的外泌体分离,不适用血清/血浆中外泌体的抽提,如果需要进行血清/血浆的外泌体分离,请选用血清/血浆外泌体快速抽提试剂盒。
4)为了您的安全和健康,请穿实验服并戴一次性手套操作。
5)本产品仅作科研用途!
操作方法
样品制备:
收集细胞培养基至15 mL离心管中,3000×g,离心10 min;小心收集上清,并转移至新的离心管中(勿破坏沉淀),于冰上放置待用。
注:若收集的细胞上清不能及时使用,可先放置于-20℃或-80℃冷冻。使用时,于25℃水浴锅中解冻,完全溶解后置于冰上待用。
外泌体分离:
1)试剂准备:使用前请将外泌体抽提试剂充分混匀。
2)上清预处理:吸取10 mL的细胞培养上清,加入2.5 mL外泌体抽提试剂(41201-A),涡旋振荡混匀1 min,再放置于2℃至8℃静置2h;
|
细胞培养上清 |
外泌体抽提试剂 |
用途 |
|
10 mL |
2.5 mL |
电镜、NTA粒径、Western Blot |
|
40 mL |
10 mL |
多基因核酸分析(qPCR)、测序 |
注:上述用量的推荐,仅针对外泌体分泌量高的肿瘤细胞,对于外泌体分泌量少的样品(例如干细胞)可以适当加大上清的用量。其它规格的细胞上清可以根据外泌体抽提试剂的用量进行等比例换算。
3)外泌体沉淀:取出装有混合液的离心管于4℃,10000×g离心60 min,弃上清,收集沉淀(尽可能吸尽上清)。
4)外泌体重悬:取100 μL 1×PBS均匀吹打离心沉淀物,使其充分混匀,并转移至新的1.5 mL离心管中;
注:外泌体颗粒会附着在管壁上,重悬时可以使用PBS对管壁进行反复吹打洗脱(避免剧烈吹打)。重悬用的PBS的量可以根据细胞上清的量进行等比例增加,也可以根据可能获得的外泌体的量进行适当的增加或者减少。
5)外泌体的洗涤:将含有外泌体的1.5mL离心管于4℃,12000×g离心2 min,弃沉淀,保留上清液。
6)外泌体的保存:纯化后的外泌体可于4℃保存3天,-80℃ 长期保存,避免反复冻融。
外泌体浓缩(可选):
如果获得的外泌体浓度比较低,可以使用密理博3kD孔径的超滤管于4℃,14000×g离心10-30 min,内管中即为纯化后的外泌体颗粒。
外泌体除菌(可选):
获得的外泌体后期需要与细胞共培养,可以使用0.22 μm的滤器进行过滤除菌。初次尝试时,建议外泌体蛋白浓度在10-100 μg/mL内做梯度摸索,选择一个较为合适的条件。
结果展示:
|
NTA粒径检测:结果显示通过Yeasen外泌体抽提获得的外泌体分散性好,大小均一,峰形单一。 |
|
|
|
样品来源:293T细胞培养上清。 检测仪器:ZetaView 上清用量:10 mL |
|
表面标志物分析:通过Western Blot分析外泌体表面蛋白,可以很好的检测到TSG101,CD63和MHCC的存在。 |
|
|
|
样品来源:293T细胞培养上清。 裂解方式:RIPA裂解液 上清用量:10 mL |
|
核酸分析:通过Agilent 4200分析,可以检测到较为明显的外泌体小RNA条带,足以满足下游高通量测序的需求。 |
|
|
|
样品来源:293T细胞培养上清。 检测仪器:Agilent 4200 抽提方法:Trizol 上清用量:40 mL |
相关产品推荐
|
货号 |
名称 |
规格 |
|
|
外泌体分离 |
41202JP30 |
Hieff® Quick exosome isolation kit(for Serum/Plasma) 血清/血浆外泌体快速抽提试剂盒 |
30 mL |
|
外泌体定量 |
20118JP60 |
Lysis Buffer for WB/IP Assays 免疫印迹及免疫沉淀用(WB/IP)裂解液 |
100 mL |
|
20201JP76 |
BCA Protein Quantification Kit BCA 蛋白浓度测定试剂盒(增强型) |
500 T(100 mL) |
|
|
外泌体鉴定 (Western Blot) |
36231JP10 |
Precast Protein Improve Gels, 4%-20%, 15 wells 4%-20%高分辨率梯度预制胶,15孔 |
1盒(10块) |
|
36232JP10 |
Precast Protein Improve Gels,, 8%, 10 wells 8% 高分辨率梯度预制胶,10孔 |
1盒(10块) |
|
|
36233JP10 |
Precast Protein Improve Gels,, 10%, 10 wells 10%高分辨率梯度预制胶,10孔 |
1盒(10块) |
|
|
36234JP10 |
Precast Protein Improve Gels,, 12%, 10 wells 12%高分辨率梯度预制胶,10孔 |
1盒(10块) |
|
|
36235JP10 |
Precast Protein Improve Gels,, 15%, 10 wells 15%高分辨率梯度预制胶,10孔 |
1盒(10块) |
|
|
20351JP76 |
GoldBand 3-color Regular Range Protein Marker(10-180 kDa)三色预染蛋白质分子量标准 |
2×250 μL |
|
|
20352JP76 |
GoldBand 3-color High Range Protein Marker(10-245kDa) 三色预染蛋白质分子量标准 |
2×250 μL |
|
|
外泌体标记 |
40726JP10 |
DiI (DiIC18(3)) 细胞膜橙红色荧光探针 |
10 mg |
|
40757JP25 |
DiR Iodide (DiIC18(7)) 细胞膜深红色荧光探针 |
25 mg |
详情请咨询:021-50837765
HB180517
Q:外泌体洗涤那步为什么要保留上清液?
A:因为外泌体溶解到上清中了,这个转速下外泌体还是在上清中。
Q:是利用的磁珠法还是柱法?
A:这个不属于纯化,是生物试剂 PEG。
Q:最后得到外泌体沉淀了,为什么还要再洗涤弃沉淀,沉淀是什么?
A:去除提取的或试剂中的不溶性沉淀。
Q4:无外泌体血清培养基(或者无血清培养基)在什么时候使用?
A:细胞在正常含血清的培养基中培养一定的时间后,细胞融合度约为60%-70%时,移去原有含血清的培养基,换成新鲜的无外泌体血清培养基(或者无血清培养基),继续培养24-48h,细胞融合度达到80%-95%左右时收取上清,该上清液即可用于提取外泌体。
Q5:细胞培养过程中的死细胞是否会影响外泌体的提取?
A:会的。在收获细胞时,应确定死亡细胞占比不超过5%。细胞凋亡/死亡过程中会释放大量大小不等的囊泡,它们在外泌体的提取纯化过程中会污染活细胞产生的外泌体,同时有可能产生大量杂质。
Q6:加了抽提试剂离心之后无沉淀,这个现象正常吗?
A:由于某些细胞(如悬浮细胞、干细胞、神经细胞等)中外泌体含量比较低,加了试剂A离心之后肉眼可能无法观察到沉淀,在重悬时使用PBS液朝离心管离心外侧的内壁反复吹打洗脱即可(避免剧烈吹打)。针对提取后的外泌体先进行NTA粒径检测或BCA蛋白定量检测,再决定是否进行后继实验。
[1] Li Z, Qin X, Bian W, et al. Exosomal lncRNA ZFAS1 regulates esophageal squamous cell carcinoma cell proliferation, invasion, migration and apoptosis via microRNA-124/STAT3 axis. J Exp Clin Cancer Res. 2019;38(1):477. Published 2019 Nov 27. doi:10.1186/s13046-019-1473-8(IF:11.161)
[2] Guan X, Zong ZH, Liu Y, Chen S, Wang LL, Zhao Y. circPUM1 Promotes Tumorigenesis and Progression of Ovarian Cancer by Sponging miR-615-5p and miR-6753-5p. Mol Ther Nucleic Acids. 2019;18:882-892. doi:10.1016/j.omtn.2019.09.032(IF:8.886)
[3] Chen G, Yue A, Wang M, Ruan Z, Zhu L. The Exosomal lncRNA KLF3-AS1 From Ischemic Cardiomyocytes Mediates IGF-1 Secretion by MSCs to Rescue Myocardial Ischemia-Reperfusion Injury. Front Cardiovasc Med. 2021;8:671610. Published 2021 Sep 21. doi:10.3389/fcvm.2021.671610(IF:6.050)
[4] Zhang H, Wang J, Wang Y, et al. Long Non-Coding LEF1-AS1 Sponge miR-5100 Regulates Apoptosis and Autophagy in Gastric Cancer Cells via the miR-5100/DEK/AMPK-mTOR Axis. Int J Mol Sci. 2022;23(9):4787. Published 2022 Apr 26. doi:10.3390/ijms23094787(IF:5.924)
[5] Li F, Niu R, Gao S, et al. Pro-Angiogenesis Role of LINC00662 From Esophageal Squamous Cell Carcinoma Cells-Derived Extracellular Vehicles. Front Bioeng Biotechnol. 2022;10:772514. Published 2022 Apr 1. doi:10.3389/fbioe.2022.772514(IF:5.890)
[6] Luo X, Wei J, Yang FL, et al. Exosomal lncRNA HNF1A-AS1 affects cisplatin resistance in cervical cancer cells through regulating microRNA-34b/TUFT1 axis. Cancer Cell Int. 2019;19:323. Published 2019 Dec 3. doi:10.1186/s12935-019-1042-4(IF:5.722)
[7] Wang ZF, Liao F, Wu H, Dai J. Glioma stem cells-derived exosomal miR-26a promotes angiogenesis of microvessel endothelial cells in glioma. J Exp Clin Cancer Res. 2019;38(1):201. Published 2019 May 17. doi:10.1186/s13046-019-1181-4(IF:5.646)
[8] Chen G, Wang M, Ruan Z, Zhu L, Tang C. Mesenchymal stem cell-derived exosomal miR-143-3p suppresses myocardial ischemia-reperfusion injury by regulating autophagy. Life Sci. 2021;280:119742. doi:10.1016/j.lfs.2021.119742(IF:5.037)
[9] Shang A, Wang X, Gu C, et al. Exosomal miR-183-5p promotes angiogenesis in colorectal cancer by regulation of FOXO1. Aging (Albany NY). 2020;12(9):8352-8371. doi:10.18632/aging.103145(IF:4.831)
[10] Ma R, Liang Z, Shi X, et al. Exosomal miR-486-5p derived from human placental microvascular endothelial cells regulates proliferation and invasion of trophoblasts via targeting IGF1. Hum Cell. 2021;34(5):1310-1323. doi:10.1007/s13577-021-00543-x(IF:4.174)
[11] Hu H, Xu H, Lu F, et al. Exosome-Derived miR-486-5p Regulates Cell Cycle, Proliferation and Metastasis in Lung Adenocarcinoma via Targeting NEK2 [retracted in: Front Bioeng Biotechnol. 2021 Mar 26;9:681918]. Front Bioeng Biotechnol. 2020;8:259. Published 2020 Apr 8. doi:10.3389/fbioe.2020.00259(IF:3.644)
[12] Sun LP, Xu K, Cui J, et al. Cancer‑associated fibroblast‑derived exosomal miR‑382‑5p promotes the migration and invasion of oral squamous cell carcinoma. Oncol Rep. 2019;42(4):1319-1328. doi:10.3892/or.2019.7255(IF:3.041)
[13] Liu Y, Fu W, Cao X, et al. Delivery of miR-224-5p by Exosomes from Cancer-Associated Fibroblasts Potentiates Progression of Clear Cell Renal Cell Carcinoma. Comput Math Methods Med. 2021;2021:5517747. Published 2021 May 24. doi:10.1155/2021/5517747(IF:2.238)
[14] Song H, Zhang X, Chen R, et al. Cortical Neuron-Derived Exosomal MicroRNA-181c-3p Inhibits Neuroinflammation by Downregulating CXCL1 in Astrocytes of a Rat Model with Ischemic Brain Injury. Neuroimmunomodulation. 2019;26(5):217-233. doi:10.1159/000502694(IF:1.351)