总谷胱甘肽过氧化物酶检测试剂盒(S0058)
| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| S0058 | 总谷胱甘肽过氧化物酶检测试剂盒 | 100次 | 556.00元 |
总谷胱甘肽过氧化物酶检测试剂盒(NADPH法) (Total Glutathione Peroxidase Assay Kit with NADPH)是一种简单易行的通过紫外比色来检测细胞、组织或其它样品中谷胱甘肽过氧化物酶(Glutathione peroxidase, GPx)活性的试剂盒。
绝大部分细胞内的谷胱甘肽过氧化物酶都是含硒的,且硒为该酶的活性中心组成部分。细胞内也有很少量的不含硒的谷胱甘肽过氧化物酶存在。本试剂盒可以定量检测出最常见的含硒的谷胱甘肽过氧化物酶和少量不含硒的谷胱甘肽过氧化物酶的总量。
本试剂盒和谷胱甘肽过氧化物酶检测试剂盒(S0056)配合使用,可以定量检测出样品中不含硒的谷胱甘肽过氧化物酶。
谷胱甘肽过氧化物酶可以清除活细胞内的过氧化物,在保护细胞免受自由基损伤过程中起着关键作用。细胞内的脂类容易和自由基发生反应,产生脂类过氧化物。谷胱甘肽过氧化物酶可以利用还原型谷胱甘肽(GSH)还原脂类过氧化物,从而消除自由基的毒害作用。谷胱甘肽过氧化物酶几乎在所有组织中都有分布。在一些病理状况下谷胱甘肽过氧化物酶的活力会发生明显上调或下调。
谷胱甘肽过氧化物酶可以利用还原型谷胱甘肽(GSH)催化过氧化氢以及许多有机过氧化物,产生水或有机醇。但以过氧化氢为底物进行检测会受同样可以分解过氧化氢的过氧化氢酶(Catalase)的影响,因为过氧化氢酶的酶活性会干扰谷胱甘肽过氧化物酶的测定。本试剂盒利用了一种间接测定的方法。谷胱甘肽过氧化物酶(GPx)可以催化GSH产生GSSG,而谷胱甘肽还原酶可以利用NADPH催化GSSG产生GSH,通过检测NADPH的减少量就可以计算出谷胱甘肽过氧化物酶的活力水平。在上述反应中谷胱甘肽过氧化物酶是整个反应体系的限速步骤,因此NADPH的减少量和谷胱甘肽过氧化物酶的活力线性相关。
本试剂盒利用了如下的反应原理,GPx为谷胱甘肽过氧化物酶(Glutathione peroxidase),GR为谷胱甘肽还原酶(Glutathione reductase),R-OOH为过氧化物。
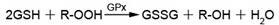
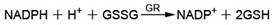
本试剂盒提供的有机过氧化物试剂(Cum-OOH)在没有谷胱甘肽过氧化物酶存在的情况下不会和GSH产生反应,也不会被细胞内的过氧化氢酶催化而分解。因而可以较为特异地检测出谷胱甘肽过氧化物酶的活力。
有机过氧化物试剂(Cum-OOH)不仅可以作为含硒的谷胱甘肽过氧化物酶的底物,也可作为不含硒的谷胱甘肽过氧化物酶的底物,因此本试剂盒可以定量检测总谷胱甘肽过氧化物酶。
本试剂盒可检测组织匀浆产物、细胞裂解产物等样品中谷胱甘肽过氧化物酶的活性。一个试剂盒可进行100次检测。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| S0058-1 | 样品匀浆液 | 100ml |
| S0058-2 | 谷胱甘肽过氧化物酶检测缓冲液 | 50ml |
| S0058-3 | 谷胱甘肽还原酶 | 100µl |
| S0058-4 | NADPH | 11.5mg |
| S0058-5 | 还原型谷胱甘肽(GSH) | 10mg |
| S0058-6 | 过氧化物试剂(Cum-OOH) | 200µl |
| — | 说明书 | 1份 |
保存条件:
-20℃保存,一年有效。NADPH溶解后宜适当分装并-70℃保存,4℃可以保存一天,-20℃保存一周后NADPH会降解10%以上。GSH在配制成溶液后,适当分装后-20℃保存。
注意事项:
本试剂盒检测时涉及到氧化还原反应,因此所有氧化剂或还原剂都会干扰本试剂盒的测定。如果在样品中的还原剂无法避免,例如DTT、巯基乙醇等,则这些还原剂的总浓度至少低于0.1mM。0.15mM的DTT可以抑制40%的酶活力。
常用的Triton X-100、Tween-20等去垢剂都含有较高水平的过氧化物,会影响本试剂盒的测定。如果必须使用这些去垢剂,最好使用纯度较高并注明含较低过氧化物的去垢剂。
加入过氧化物试剂溶液后的第一次读数,例如0分钟时A340读值不宜低于1。如果读数低于1,说明样品中的GPx活力太高,或者样品中本身的GSSG含量太高,需要将样品适当稀释或者减少样品的用量,否则反应很快就进入平台期,无法获取正常的检测数据。样品可以立即测定,也可以-70℃冻存待以后测定。
一定要严格控制反应时的温度为25℃,否则会引起较多误差。
NADPH不太稳定,要严格按照后续说明操作,谨防失活。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1.样品的准备:
a.细胞样品的准备:对于贴壁细胞,由于后续用于酶活性的测定,应避免使用胰酶消化细胞。可以使用EDTA处理细胞或用细胞铲或细胞刮(FLFT021/FSCP023/FSCP029)收集细胞。细胞用PBS或生理盐水洗涤一遍。后续(a)和(b)步骤可以任选其一(优先推荐步骤(a)):
(a).可以用碧云天生产的Western及IP细胞裂解液(P0013)参考相应说明裂解细胞样品。按照每100万细胞加入100-200微升裂解液的比例进行裂解。如果出现裂解效果不佳的情况,可以把处在裂解液中的细胞样品用玻璃匀浆器在4℃或冰浴匀浆。随后4℃,12000g离心10分钟。取上清用于酶活性的测定。
(b).可以用本试剂盒中的样品匀浆液,按照每100万细胞加入100-200微升样品匀浆液的比例用玻璃匀浆器在4℃或冰浴匀浆。随后4℃,12,000g离心10分钟。取上清用于酶活性的测定。
b.组织样品的准备:动物用含有0.16mg/ml heparin的生理盐水(0.9% NaCl containing 0.16mg/ml heparin)灌流清除血液后获取组织样品。按照约每20mg组织加入200微升样品匀浆液的比例,用TissueMaster™手持式组织研磨仪(E6600)或玻璃匀浆器在4℃或冰浴匀浆。4℃,12,000g离心10分钟。取上清用于酶活性的测定。
c.红细胞裂解液的准备:用抗凝管收集血液,颠倒混匀。取至少500微升全血4℃ 2500g离心5分钟。弃上清,用冰冷的约红细胞沉淀10倍体积的样品匀浆液重悬沉淀,再同前离心,弃上清。加入约红细胞沉淀4倍体积的冰冷的Milli-Q级纯水裂解红细胞。12,000g离心5分钟,取上清。
d.上述各种样品可以用碧云天生产的BCA蛋白浓度测定试剂盒(P0009/P0010/P0010S/P0011/P0012/P0012S)测定蛋白浓度。通常可以先取含1-100微克蛋白的样品用于谷胱甘肽过氧化物酶的检测。注:对于GPx活力较高的组织样品,含1-10微克蛋白的样品可能就能满足检测需求,而对于GPx活力较低的样品例如某些细胞样品,可能需要10-100微克的蛋白量。如果发现样品中谷胱甘肽过氧化物酶的活力过高,可以用谷胱甘肽过氧化物酶检测缓冲液进行稀释。如果样品中谷胱甘肽过氧化物酶的活力过低,则需适当加大蛋白用量。准备好的样品如果当日测定,可以在冰浴保存,如果日后测定可以-70℃冻存。
2.试剂盒的准备工作:
a.62.5mM NADPH溶液的配制。在本试剂盒提供的11.5mg NADPH中加入220微升Milli-Q级纯水,溶解并混匀,即为62.5mM NADPH溶液。除立即待用部分外,其余的NADPH溶液需适当分装后-70℃保存。
b.75mM GSH溶液的配制。在本试剂盒提供的10mg GSH中加入433微升Milli-Q级纯水,溶解并混匀,即为75mM GSH溶液。除立即待用部分外,其余的GSH溶液需适当分装后-20℃保存。
c.GPx检测工作液的配制。根据待测定的样品数(含对照),按照每个检测需要40微升GPx检测工作液的体积配制适量的GPx检测工作液。配制好的GPx检测工作液仅限当日使用,且需尽量在冰浴上存放。具体配制方法参考下表。
| 可测定样品数(含对照) | 1个样品 | 10个样品 | 20个样品 |
| 谷胱甘肽过氧化物酶检测缓冲液 | 35 µl | 350 µl | 700 µl |
| 62.5mM NADPH | 2 µl | 20 µl | 40 µl |
| 75mM GSH | 2 µl | 20 µl | 40 µl |
| 谷胱甘肽还原酶 | 1 µl | 10 µl | 20 µl |
| GPx检测工作液 | 40 µl | 400 µl | 800 µl |
d.30mM过氧化物试剂溶液的配制。取21.5微升过氧化物试剂(Cum-OOH)加入5毫升Milli-Q级纯水,混匀,即配制成30mM过氧化物试剂溶液。配制好的30mM过氧化物试剂溶液仅限当日使用,且需尽量在冰浴上存放。
e.所有试剂使用前须在水浴中或PCR仪等设备上温育到25℃。
3.样品测定:
a.参考下表,使用96孔板,依次加入检测缓冲液、待测样品和GPx检测工作液,混匀,加入40微升GPx检测工作液后,室温孵育15分钟,以消耗掉样品中的GSSG,排除对后继检测的干扰。
| 空白对照 (blank) | 样品 (sample) | |
| 谷胱甘肽过氧化物酶检测缓冲液 | 50 µl | 0-50 µl |
| 待测样品 | - | 0-50 µl |
| GPx检测工作液 | 40 µl | 40 µl |
| 总体积 | 90 µl | 90 µl |
b. 每孔加入10微升30mM过氧化物试剂溶液,混匀。
c.立即使用适当的酶标仪或微量紫外分光光度计测定A340,此时记录为0分钟读值。如果仪器可以设置温度,把温度设置在25℃,否则可以通过空调调节室温到25℃,待预计仪器也达到25℃后再开始测定A340。
d.连续测定5分钟或自动每隔1分钟测定一次A340。如果仪器不具备相应功能,可以手工操作,每隔1分钟记录A340值,至少连续记录5分钟,获得6个点的数据。
注1:连续测定的时间可以根据样品中GPx的活力来调整,但是需确保获得6个点的数据。对于GPx的活力较高的样品,例如肝脏等组织样品,建议测定5分钟或10分钟,对应的测定间隔时间设为1分钟和2分钟;对于GPx的活力很低的样品,例如THP-1等细胞样品,可以延长测定时间为10、15或者20分钟,对应的测定间隔时间设为2、3或4分钟。也可以连续测定20分钟,每隔1分钟测定1次,最后取呈线性的时间点前的数据来分析。
注2:如果样品的第一次读数比如0分钟时A340读值低于1,说明样品中的GPx活力太高,或者样品中本身的GSSG含量太高,需要将样品适当稀释或者减少样品的用量。
e.测定出来的ΔA340/min最好能控制在0.01-0.2范围内。如测定出来的ΔA340/min数值过大,则可以把样品适当稀释或者减小样品的用量,如ΔA340/min数值过小,处理样品时需设法尽量浓缩样品、并适当加大样品的用量。蛋白量为12微克的THP-1细胞样品和蛋白量为4微克的小鼠肝脏样品的检测效果参考表1、表2和图1。
表1.蛋白量为12微克的THP-1细胞样品检测数据分析。
| 读值 | 0min | 3min | 6min | 9min | 12min | 15min |
| A340 (blank) | 1.50 | 1.35 | 1.22 | 1.08 | 0.96 | 0.86 |
| A340 (sample) | 1.44 | 1.21 | 0.98 | 0.72 | 0.50 | 0.32 |
| ΔA340 (blank) | 0.00 | 0.15 | 0.28 | 0.42 | 0.54 | 0.64 |
| ΔA340 (sample) | 0.00 | 0.23 | 0.46 | 0.72 | 0.94 | 1.12 |
| ΔA340 | 0.00 | 0.08 | 0.18 | 0.30 | 0.40 | 0.48 |
| ΔA340/min | 0 | 0.0267 | 0.03 | 0.033 | 0.033 | 0.032 |
表2. 蛋白量为4微克的小鼠肝脏样品的检测数据分析。
| 读值 | 0min | 1min | 2min | 3min | 4min | 5min |
| A340 (blank) | 1.72 | 1.62 | 1.57 | 1.51 | 1.49 | 1.46 |
| A340 (sample) | 1.37 | 1.12 | 0.95 | 0.79 | 0.62 | 0.45 |
| ΔA340 (blank) | 0.00 | 0.10 | 0.15 | 0.21 | 0.23 | 0.26 |
| ΔA340 (sample) | 0.00 | 0.25 | 0.41 | 0.58 | 0.75 | 0.92 |
| ΔA340 | 0.00 | 0.15 | 0.26 | 0.37 | 0.52 | 0.66 |
| ΔA340/min | 0 | 0.15 | 0.13 | 0.123 | 0.13 | 0.132 |
注:ΔA340 (blank)=A340 (blank) (Time 0)-A340 (blank) (Time n)
ΔA340 (sample)=A340 (sample) (Time 0)-A340 (sample) (Time n)
ΔA340=ΔA340 (sample)-ΔA340 (blank)
ΔA340/min=ΔA340/n
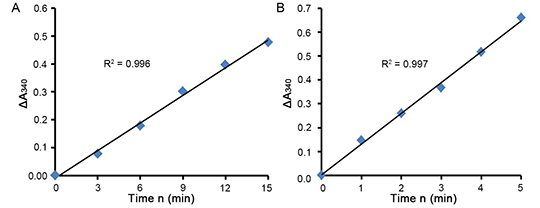
图1.本试剂盒用于THP-1细胞样品和小鼠肝脏样品的检测效果图。横坐标为测定的各个时间点n,纵坐标为相应时间点ΔA340 (sample)与ΔA340 (blank)的差值即ΔA340。图A为蛋白量为12微克的THP-1细胞样品测定15分钟的检测效果,图B为蛋白量为4微克的小鼠肝脏样品测定5分钟的检测效果。实测数据会因实验条件、检测仪器等的不同而存在差异,图中数据仅供参考。
4.样品中谷胱甘肽过氧化物酶酶活力的计算:
a.谷胱甘肽过氧化物酶酶活力单位的定义:1个酶活力单位(1 unit)在25℃,pH8.0,在GSH、谷胱甘肽还原酶、Cum-OOH存在的条件下,在1分钟内可以催化1微摩尔NADPH转变成NADP+。1 U=1000 mU。
b.对于谷胱甘肽过氧化物酶溶液:1mU/ml=1nmol NADPH/min/ml=(A340/min)/(εμM×L(cm))
即相当于:[检测体系中谷胱甘肽过氧化物酶活力]=(ΔA340/min)/(εμM×L(cm))=[(ΔA340 (sample)-ΔA340 (blank))/min]/ (εμM×L(cm))
[样品中谷胱甘肽过氧化物酶活力]=[检测体系中谷胱甘肽过氧化物酶活力]×[稀释倍数]/[样品中的蛋白浓度]= [(ΔA340/min)/(εμM×L(cm))]×[dil×(V(ml)/Vsample(ml))]/[样品中的蛋白浓度]
注:[检测体系中谷胱甘肽过氧化物酶活力]的单位为mU/ml,[样品中的蛋白浓度]的单位为mg/ml,所以最终[样品中谷胱甘肽过氧化物酶活力]的单位为:U/mg蛋白或mU/mg蛋白;
εμM为摩尔消光系数:NADPH在A340的摩尔消光系数为0.00622μM-1cm-1;
L(cm)为测吸光度时的路径长度:100μl样品在一般的96孔中的高度约为0.276cm,如果使用不同的反应孔,请注意修改为溶液在该孔中的高度;
dil为样品的稀释倍数;
V(ml)为反应体系,本反应体系为0.1ml;
c.Vsample(ml)为反应体系中样品的体积,以毫升表示。计算示例:样品的蛋白浓度经测定为1.2mg/ml,用样品稀释液稀释2倍后,取20微升稀释后的样品参考表1进行测定,测定时间设为15分钟。如果0分钟时的A340 (sample)=1.44,A340 (blank)=1.50,15分钟时的A340 (sample)=0.32,A340 (blank)=0.86,则ΔA340 (sample)=1.44-0.32=1.12,ΔA340 (blank)=1.50-0.86=0.64,那么:
[检测体系中谷胱甘肽过氧化物酶活力]= [ (1.12-0.64)/15]/(0.00622×0.276)=18.64mU/ml
[样品中谷胱甘肽过氧化物酶活力]= 18.64mU/ml×(2×0.1/0.02)/(1.2mg/ml)=155mU/mg(蛋白)
相关产品
| 产品编号 | 产品名称 | 包装 |
| S0052 | 总谷胱甘肽检测试剂盒 | 100次 |
| S0053 | GSH和GSSG检测试剂盒 | 共100次 |
| S0055 | 谷胱甘肽还原酶检测试剂盒 | 100次 |
| S0056 | 谷胱甘肽过氧化物酶检测试剂盒(NADPH法) | 100次 |
| S0057 | 谷胱甘肽过氧化物酶检测试剂盒(DTNB法) | 100次 |
| S0058 | 总谷胱甘肽过氧化物酶检测试剂盒(NADPH法) | 100次 |
| S0059 | 总谷胱甘肽过氧化物酶检测试剂盒(DTNB法) | 100次 |

