过碘酸-雪夫(PAS)染色试剂盒(C0142M)
| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| C0142S | 过碘酸-雪夫(PAS)染色试剂盒 | 100次 | 96.00元 |
| C0142M | 过碘酸-雪夫(PAS)染色试剂盒 | 500次 | 352.00元 |
碧云天生产的过碘酸-雪夫染色试剂盒(Periodic Acid-Schiff Staining Kit),即PAS染色试剂盒,也称糖原PAS染色液试剂盒(Glycogen Periodic Acid-Schiff Staining Kit),是一种使用过碘酸、雪夫(Schiff)试剂对组织中糖原、粘多糖及真菌等进行染色的试剂盒。本试剂盒适用于不同组织的石蜡切片或冰冻切片、培养的细胞、血涂片、骨髓涂片等样品。
过碘酸-雪夫染色,即PAS染色,因其主要用于多糖(polysaccharides)如糖原(glycogen)和粘性物质(mucosubstances)如黏多糖(glycosaminoglycan)、黏蛋白(mucins)、糖蛋白(glycoproteins)和糖脂(glycolipids)等物质的染色,所以也称糖原染色(Glycogen Staining)。过碘酸-雪夫染色是病理学中常规的染色方法之一,McManus在1946年最先使用过碘酸-雪夫技术显示黏蛋白,该染色法不仅能够显示糖原还能显示中性粘液性物质和某些酸性物质以及软骨、垂体、真菌、色素、淀粉样物质、基底膜等。另外,临床诊疗中PAS染色常用于辅助淋巴细胞性白血病的诊断。
糖原是由D-葡萄糖的分支或直链组成的高分子多糖类化合物,糖原的合成与分解代谢主要发生在肝、肾和肌肉组织中。过碘酸是一种强氧化剂,能将组织或者细胞中的糖原及有关物质中的1,2-乙二醇基(CHOH-CHOH)氧化成两个游离醛基(-CHO),且过碘酸的特点是不再继续将醛基氧化成羧基。Schiff试剂(Schiff reagent),又称品红亚硫酸试剂,含碱性品红和亚硫酸,碱性品红与亚硫酸结合后,失去醌式结构而生成无色品红。无色品红与过碘酸氧化的游离醛基结合,醌式结构恢复,生成洋红色(magenta)产物,定位于胞浆,颜色深浅与多糖含量成正比。
| Samples | Color |
| PAS Positive Material | Magenta |
| Fungal Organisms | Magenta |
| Nuclei | Blue |
| Background | Light Purple |
由于单糖在固定、脱水和包埋等组织化学操作过程中被抽提掉,故一般组织标本上所能显示的糖类主要是糖原和其它多糖物质,因此如有需要可设置对照试验确定此洋红色物质是否为糖原:糖原可被淀粉酶(amylase)水解,先用淀粉酶处理后再进行PAS染色,若反应为阴性,则表明被染色的物质为糖原,反之则为其它多糖。
本试剂盒提供了过碘酸-雪夫(PAS)染色所需的过碘酸溶液、Schiff试剂、苏木素染色液和盐酸乙醇分化液等试剂,用户只需自备梯度乙醇即可完成整个染色过程。
本试剂盒操作简单方便,性能稳定,染色效果明显。本试剂盒用于小鼠小肠石蜡切片的染色效果图参考图1。
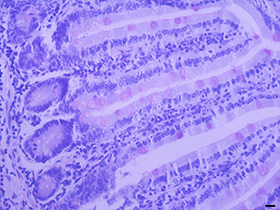
图2. 碧云天的过碘酸-雪夫(PAS)染色试剂盒用于小鼠小肠石蜡切片的染色效果图。如图所示,糖原和其它多糖被染成洋红色,细胞核被苏木素染色呈蓝色。Scar=50µm。实际染色效果会因样品、检测条件的不同而略有差异,本图仅供参考。
本试剂盒C0142S和C0142M用于切片的染色,每个切片样品各使用100μl染色液,可以分别进行100次和500次染色。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| C0142S-1 | 过碘酸溶液 | 10ml |
| C0142S-2 | Schiff试剂 | 10ml |
| C0142S-3 | 苏木素染色液 | 10ml |
| C0142S-4 | 盐酸乙醇分化液 | 10ml |
| — | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| C0142M-1 | 过碘酸溶液 | 50ml |
| C0142M-2 | Schiff试剂 | 50ml |
| C0142M-3 | 苏木素染色液 | 50ml |
| C0142M-4 | 盐酸乙醇分化液 | 50ml |
| — | 说明书 | 1份 |
保存条件:
4℃保存,一年有效。除C0142-4 盐酸乙醇分化液外,都需要避光保存。C0142-1 过碘酸溶液和C0142-2 Schiff试剂需要注意密封保存,并且如果短期内不使用,推荐-20℃保存,-20℃可以保存更长时间。C0142-3 苏木素染色液和C0142-4 盐酸乙醇分化液都可以室温保存。
注意事项:
过碘酸溶液和Schiff试剂应置于4℃密封避光保存,使用时尽量避免接触过多的光照和空气。使用前,建议提前30分钟取出平衡至室温后,避光暗处使用。如果过碘酸溶液变黄或者Schiff试剂变红则不能继续使用。
染色过程中应尽量缩短蒸馏水洗涤的时间,避免糖原被水洗掉。
过碘酸溶液氧化时间不宜过短或过长,氧化时的温度以18-22℃为佳。
苏木素染色液应淡染,避免染色过深影响观察效果。
染色后的分化为选做步骤,分化后细胞核染色变浅,可根据染色需求决定是否进行分化。盐酸乙醇分化液应经常更换新液,其分化时间应该依据切片厚薄、 组织的类别和盐酸乙醇分化液的新旧程度而定。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
1.样品处理。
a.对于石蜡切片:
石蜡切片的制备:按照常规方法进行取材、固定、洗涤、脱水、透明、浸蜡、包埋、切片、烘片等步骤制备石蜡切片。
二甲苯中脱蜡5-10分钟。
换用新鲜的二甲苯,再脱蜡5-10分钟。
无水乙醇5分钟。
90%乙醇2分钟。
80%乙醇2分钟。
70%乙醇2分钟。
蒸馏水洗涤2分钟。
b.对于冰冻切片:
冰冻切片的制备:按照常规方法进行取材、速冻、切片、烘片等步骤制备冰冻切片。
蒸馏水洗涤2分钟。
c.对于血涂片、骨髓涂片:
按照常规方法制作血涂片或骨髓涂片,自然晾干。
70%乙醇固定10分钟,蒸馏水冲洗,晾干。
d.对于细胞:
加入70%的乙醇固定10分钟。
2.PAS染色。
a.过碘酸溶液氧化:取出过碘酸溶液并平衡至室温,每个样品滴加过碘酸溶液100μl,在湿盒中避光反应10分钟后,去除过碘酸溶液,浸泡于蒸馏水中并置于摇床洗涤5分钟。
b.Schiff试剂染色:每个样品滴加100μl Schiff试剂,放入湿盒中,置于37℃烘箱避光染色30分钟~1小时。去除染色液,浸泡于蒸馏水中并置于摇床洗涤5分钟。注:不同组织的最佳染色时间可能会有差异,请根据实际染色效果调整染色时间。
c.苏木素染色:每个样品滴加100μl苏木素染色液,染色30秒。去除染色液,蒸馏水漂洗两次以上,每次3秒钟,直到浮色洗去。对于涂片,待适当干燥后,即可用封片液封片,在显微镜下观察。细胞可用蒸馏水洗去多余的颜色,即可在显微镜下拍照。
d.分化(选做):使用盐酸乙醇分化液分化30秒,去除分化液,自来水漂洗两次,每次三秒钟,自来水返蓝5分钟。
e.脱水、透明:放入90%乙醇、无水乙醇脱水各2分钟,二甲苯两次透明各5分钟。
f.封片:使用中性树胶封片。在显微镜下观察和拍照。
相关产品:
| 产品编号 | 产品名称 | 包装 |
| C0105S | 苏木素伊红(HE)染色试剂盒 | >200次 |
| C0105M | 苏木素伊红(HE)染色试剂盒 | >1000次 |
| C0107-100ml | 苏木素染色液 | 100ml |
| C0107-500ml | 苏木素染色液 | 500ml |
| C0109 | 伊红染色液 | 100ml |
| C0115 | 甲基绿染色液 | 100ml |
| C0117 | 尼氏(Nissl)染色液 | 100ml |
| C0119 | 甲基绿-派洛宁染色液 | 100ml |
| C0121-100ml | 结晶紫染色液 | 100ml |
| C0121-500ml | 结晶紫染色液 | 500ml |
| C0123 | 中性红染色液 | 100ml |
| C0125 | 中性红染色液(活细胞染色用) | 100ml |
| C0131-100ml | 改良吉姆萨染色液(20X) | 100ml |
| C0131-500ml | 改良吉姆萨染色液(20X) | 500ml |
| C0133-100ml | 吉姆萨染色液(10X) | 100ml |
| C0133-500ml | 吉姆萨染色液(10X) | 500ml |
| C0135-100ml | 瑞氏染色液 | 100ml |
| C0135-500ml | 瑞氏染色液 | 500ml |
| C0138-100ml | 茜素红S染色液(2%, pH4.2) | 100ml |
| C0140-100ml | 茜素红S染色液(0.2%, pH8.3) | 100ml |
| C0142S | 过碘酸-雪夫(PAS)染色试剂盒 | 100次 |
| C0142M | 过碘酸-雪夫(PAS)染色试剂盒 | 500次 |
| C0151-100ml | 核固红染色液 | 100ml |
| C0153S | 阿尔新蓝-核固红染色试剂盒(pH1.0) | 100次 |
| C0153M | 阿尔新蓝-核固红染色试剂盒(pH1.0) | 500次 |
| C0155S | 阿尔新蓝-核固红染色试剂盒(pH2.5) | 100次 |
| C0155M | 阿尔新蓝-核固红染色试剂盒(pH2.5) | 500次 |
| C0157S | 油红O染色试剂盒 | 50次 |
| C0157M | 油红O染色试剂盒 | 200次 |

