淋巴细胞分离液1.084 即用型无菌分离液|Lymphocyte separation medium1.084
产品说明书
FAQ
COA
已发表文献
产品描述
淋巴细胞分离液(Lymphocyte Separation Medium 1.084,简称LSM-1.084)是一种无菌的即用型分离液,基于Böyum的Ficoll-甲泛影钠溶液做过一些改良,使得操作简单快速且分离效率更高。本品是无菌的聚蔗糖Ficoll/泛影酸钠混合溶液,密度为1.084 g/ml,内毒素含量很低(<0.12 EU/mL),是在严格控制的环境下加工生产的,生产条件符合ISO13485:2003标准和GMP认证。相对于密度为1.077 g/mL的人淋巴细胞分离液,本品适用于分离更高密度的人单个核细胞,包括外周血,脐带血以及骨髓瘤来源的组织样本。还适用于分离大小鼠血细胞,正因为啮齿动物的淋巴细胞密度稍高于人淋巴细胞。
工作原理
去纤维蛋白或抗凝人血以1:1的比例用无菌生理盐水或平衡盐溶液稀释,小心的添加在分离液上层(不要混杂在一起),之后离心30-40 min。离心过程中,差速迁移使其最终形成几个不同的细胞分层:
① 聚集在管底的颗粒主要是Ficoll 聚集的红细胞以及沉淀物;
② 紧挨着上面一层的颗粒主要是粒细胞,其处于LSM-1.084溶液的渗透压临界,具有足够高的密度迁移穿过LSM-1.084溶液层。
③ 单个核细胞分布在血浆和LSM-1.084分离液的中间层,还包括一些沉降系数低(密度低)的颗粒,如血小板。
淋巴细胞,单核细胞和血小板不具有足够高的密度穿透LSM-1.084分离液层,因此这些细胞在血浆和LSM-1.084分离液层聚集形成一个中间分层。吸取中间层,用平衡盐溶液短暂洗涤,以除去血小板,细胞分离介质和血浆,就可以分离单个核细胞。通常情况下,分离所得的细胞中95±5%为单个核细胞,细胞存活率>90%,回收率为60±20%。
运输与保存方法
室温运输。4-30 °C密闭避光环境下可稳定保存3年,开瓶后需4–8 °C保存。
影响单个核细胞分离效果的因素
1. 血液样品保存时间
血液尽可能新鲜且无血块,为获得最佳分离效果,最好在取血2h内进行实验。血液放置过久可能会降低细胞存活率、回收率,甚至有可能引入粒细胞和红细胞污染,放置超过6h可能会严重影响分离效果。
2. 血液体积
血液量和管径决定样本在管子中的高度,以及后续的离心时间。提高离心管内的血液高度会引入红细胞污染的可能。但是分离效率不会明显受管径的影响。因此,对于体积大的血样,建议可在保持离心时间不变的情况下选择更大直径的离心管。
3. 红细胞去除
单个核细胞分离的产量和纯度与红细胞是否去除干净有关。
若全血中红细胞发生凝集会导致一些单个核细胞也被聚集在内,从而在离心后被沉降在红细胞层内。可通过稀释全血的方法来避免此现象。温度大小会影响红细胞的凝集,18℃条件能提供最佳的分离效果。若温度升高(如37℃)会提高红细胞凝集的可能,降低分离效果。低温(4℃)环境红细胞聚集可能降低,需要增加离心时间。提高离心时间到5-10 min能减低红细胞污染。
4. 血小板污染
对于血小板要求较为严格的分离实验,使用4-20%的蔗糖梯度层加在LSM-1.084溶液层上方,再次离心以去除所有的血小板。离心后,血小板分布在蔗糖溶液上方,单个核细胞穿过蔗糖溶液停留在LSM-1.084溶液上方。
操作方法
1. 材料准备
1)样本体积(4 mL总体积):取2 mL的去纤维蛋白或抗凝血,将其与等体积(2 mL)的无菌盐溶液以1:1比例混合。注:大体积的血样可以得到相同的分离效率,只需要选用更大直径的离心管,以维持血样的高度(约3 cm)和LSM-1.084溶液的高度(约2.4 cm)。
2)LSM-1.084分离液,使用前需放到室温环境下温度平衡10-30 min;
3)平衡盐溶液:用做稀释和清洗液,建议直接购买商业化的盐溶液。也可以使用其他溶液,如不含Ca2+/Mg2+的磷酸盐溶液(如DPBS溶液),Hank’s,或者细胞培养液(如RPMI 1640)。
2. 分离单个核细胞
1)取2 mL的去纤维蛋白或抗凝血,将其与等体积(2 mL)的无菌盐溶液以1:1比例混合,于10-15 mL离心管中颠倒混匀,或用枪上下轻轻吹打数次以至混匀。
注:肝素、EDTA、柠檬酸钠、ACD、CPD抗凝皆可。去纤维蛋白血不需要抗凝剂。
2)使用前轻轻颠倒瓶子使LSM-1.084充分混合,用注射器或枪头无菌条件转移3 mL LSM到10-15 mL离心管中。
3)小心将稀释血液加入3 mL LSM-1.084(室温即可)的上层,使得在血液和LSM间形成一个明显的分层。不要将稀释血液混入LSM-1.084中,如图1。
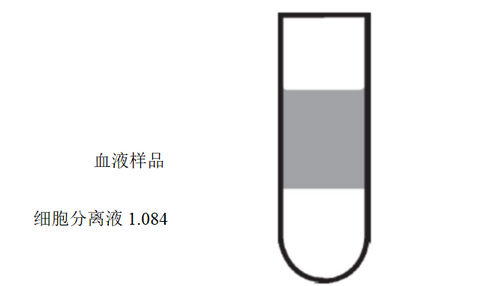
图1. 加样后分层示意图
4)室温下400×g离心30-40 min,离心可以沉淀红细胞和多形核白细胞,同时可以在LSM-1.084上形成一层单核-淋巴细胞分层,如图2所示(从上到下,依次分为血浆层-单个核细胞层-LSM-1.084层-粒细胞-红细胞)。
5)用无菌枪头吸掉单个核细胞层(含淋巴细胞和单核细胞)上方2-3 mm的血小板/血浆,小心操作勿吸入单个核细胞层内破坏其平衡(如图2)。
注:也可以不用先吸走血浆层,直接用枪吸取单个核细胞层。另外,上层血浆不含细胞,也可以留作他用。
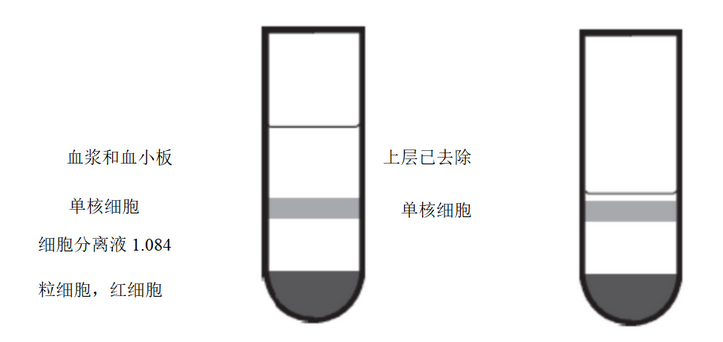
图2.吸除上层血浆和血小板前后分层示意图
6)用无菌枪头将单核细胞层转移入一个新的无菌离心管。
注:一定要吸取所有的单个核细胞中间层,以及少量上方的血浆液和下方的LSM-1.084分离液。
7)预估转移后的单个核细胞量,加入至少3倍体积(约6 mL)的平衡盐溶液于上述离心管中。
8)使用枪头上下轻轻吹打将单层细胞溶液充分悬浮。
9)室温400-500×g离心10-15 min。
注:高速离心有助于提高单个核细胞的回收率,但如果需要彻底去除血小板,则推荐低速离心(60-100×g)。
10)去除上清,加入6-8 mL平衡盐溶液重悬单核细胞。
11)室温400-500×g(或者60-100×g去除血小板)离心10 min。
12)去除上清,用适当培养基重悬单个核细胞备用。
3. 分离粒细胞
1)-6)同上方单个核细胞的分离步骤。
7)小心吸除LSM-1.084层,注意切勿吸入粒细胞层。
8)转移暴露在表面的白色粒细胞层(位于红细胞层上方)于一个无菌的50mL离心管。
9)加入至少5倍体积的平衡盐溶液重悬粒细胞,于400×g离心15 min。
10)吸除上清,加入6-8 mL平衡盐缓溶液重悬粒细胞,于室温400-500×g离心10 min。
11)吸除上清,用适当培养液重悬粒细胞备用。
注意事项
1)稀释去纤维蛋白血液或肝素化血液用的盐溶液为无菌液体。
2)为保持淋巴细胞的活性,应该采血后尽快进行分离。分离细胞层实际上是单个核细胞层,包括淋巴细胞和单核细胞。
3)为了您的安全和健康,请穿实验服并戴一次性手套操作;
4)本产品仅作科研用途!
HB211105
产品描述
淋巴细胞分离液(Lymphocyte Separation Medium 1.084,简称LSM-1.084)是一种无菌的即用型分离液,基于Böyum的Ficoll-甲泛影钠溶液做过一些改良,使得操作简单快速且分离效率更高。本品是无菌的聚蔗糖Ficoll/泛影酸钠混合溶液,密度为1.084 g/ml,内毒素含量很低(<0.12 EU/mL),是在严格控制的环境下加工生产的,生产条件符合ISO13485:2003标准和GMP认证。相对于密度为1.077 g/mL的人淋巴细胞分离液,本品适用于分离更高密度的人单个核细胞,包括外周血,脐带血以及骨髓瘤来源的组织样本。还适用于分离大小鼠血细胞,正因为啮齿动物的淋巴细胞密度稍高于人淋巴细胞。
工作原理
去纤维蛋白或抗凝人血以1:1的比例用无菌生理盐水或平衡盐溶液稀释,小心的添加在分离液上层(不要混杂在一起),之后离心30-40 min。离心过程中,差速迁移使其最终形成几个不同的细胞分层:
① 聚集在管底的颗粒主要是Ficoll 聚集的红细胞以及沉淀物;
② 紧挨着上面一层的颗粒主要是粒细胞,其处于LSM-1.084溶液的渗透压临界,具有足够高的密度迁移穿过LSM-1.084溶液层。
③ 单个核细胞分布在血浆和LSM-1.084分离液的中间层,还包括一些沉降系数低(密度低)的颗粒,如血小板。
淋巴细胞,单核细胞和血小板不具有足够高的密度穿透LSM-1.084分离液层,因此这些细胞在血浆和LSM-1.084分离液层聚集形成一个中间分层。吸取中间层,用平衡盐溶液短暂洗涤,以除去血小板,细胞分离介质和血浆,就可以分离单个核细胞。通常情况下,分离所得的细胞中95±5%为单个核细胞,细胞存活率>90%,回收率为60±20%。
运输与保存方法
室温运输。4-30 °C密闭避光环境下可稳定保存3年,开瓶后需4–8 °C保存。
影响单个核细胞分离效果的因素
1. 血液样品保存时间
血液尽可能新鲜且无血块,为获得最佳分离效果,最好在取血2h内进行实验。血液放置过久可能会降低细胞存活率、回收率,甚至有可能引入粒细胞和红细胞污染,放置超过6h可能会严重影响分离效果。
2. 血液体积
血液量和管径决定样本在管子中的高度,以及后续的离心时间。提高离心管内的血液高度会引入红细胞污染的可能。但是分离效率不会明显受管径的影响。因此,对于体积大的血样,建议可在保持离心时间不变的情况下选择更大直径的离心管。
3. 红细胞去除
单个核细胞分离的产量和纯度与红细胞是否去除干净有关。
若全血中红细胞发生凝集会导致一些单个核细胞也被聚集在内,从而在离心后被沉降在红细胞层内。可通过稀释全血的方法来避免此现象。温度大小会影响红细胞的凝集,18℃条件能提供最佳的分离效果。若温度升高(如37℃)会提高红细胞凝集的可能,降低分离效果。低温(4℃)环境红细胞聚集可能降低,需要增加离心时间。提高离心时间到5-10 min能减低红细胞污染。
4. 血小板污染
对于血小板要求较为严格的分离实验,使用4-20%的蔗糖梯度层加在LSM-1.084溶液层上方,再次离心以去除所有的血小板。离心后,血小板分布在蔗糖溶液上方,单个核细胞穿过蔗糖溶液停留在LSM-1.084溶液上方。
操作方法
1. 材料准备
1)样本体积(4 mL总体积):取2 mL的去纤维蛋白或抗凝血,将其与等体积(2 mL)的无菌盐溶液以1:1比例混合。注:大体积的血样可以得到相同的分离效率,只需要选用更大直径的离心管,以维持血样的高度(约3 cm)和LSM-1.084溶液的高度(约2.4 cm)。
2)LSM-1.084分离液,使用前需放到室温环境下温度平衡10-30 min;
3)平衡盐溶液:用做稀释和清洗液,建议直接购买商业化的盐溶液。也可以使用其他溶液,如不含Ca2+/Mg2+的磷酸盐溶液(如DPBS溶液),Hank’s,或者细胞培养液(如RPMI 1640)。
2. 分离单个核细胞
1)取2 mL的去纤维蛋白或抗凝血,将其与等体积(2 mL)的无菌盐溶液以1:1比例混合,于10-15 mL离心管中颠倒混匀,或用枪上下轻轻吹打数次以至混匀。
注:肝素、EDTA、柠檬酸钠、ACD、CPD抗凝皆可。去纤维蛋白血不需要抗凝剂。
2)使用前轻轻颠倒瓶子使LSM-1.084充分混合,用注射器或枪头无菌条件转移3 mL LSM到10-15 mL离心管中。
3)小心将稀释血液加入3 mL LSM-1.084(室温即可)的上层,使得在血液和LSM间形成一个明显的分层。不要将稀释血液混入LSM-1.084中,如图1。
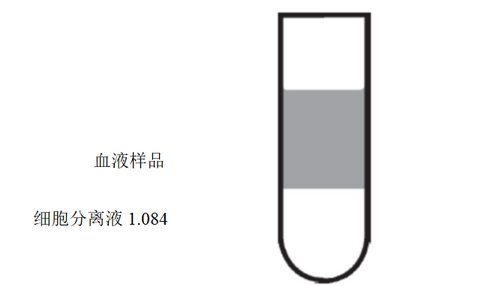
图1. 加样后分层示意图
4)室温下400×g离心30-40 min,离心可以沉淀红细胞和多形核白细胞,同时可以在LSM-1.084上形成一层单核-淋巴细胞分层,如图2所示(从上到下,依次分为血浆层-单个核细胞层-LSM-1.084层-粒细胞-红细胞)。
5)用无菌枪头吸掉单个核细胞层(含淋巴细胞和单核细胞)上方2-3 mm的血小板/血浆,小心操作勿吸入单个核细胞层内破坏其平衡(如图2)。
注:也可以不用先吸走血浆层,直接用枪吸取单个核细胞层。另外,上层血浆不含细胞,也可以留作他用。
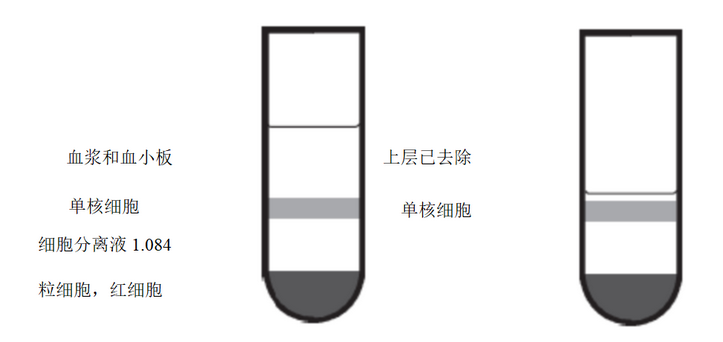
图2.吸除上层血浆和血小板前后分层示意图
6)用无菌枪头将单核细胞层转移入一个新的无菌离心管。
注:一定要吸取所有的单个核细胞中间层,以及少量上方的血浆液和下方的LSM-1.084分离液。
7)预估转移后的单个核细胞量,加入至少3倍体积(约6 mL)的平衡盐溶液于上述离心管中。
8)使用枪头上下轻轻吹打将单层细胞溶液充分悬浮。
9)室温400-500×g离心10-15 min。
注:高速离心有助于提高单个核细胞的回收率,但如果需要彻底去除血小板,则推荐低速离心(60-100×g)。
10)去除上清,加入6-8 mL平衡盐溶液重悬单核细胞。
11)室温400-500×g(或者60-100×g去除血小板)离心10 min。
12)去除上清,用适当培养基重悬单个核细胞备用。
3. 分离粒细胞
1)-6)同上方单个核细胞的分离步骤。
7)小心吸除LSM-1.084层,注意切勿吸入粒细胞层。
8)转移暴露在表面的白色粒细胞层(位于红细胞层上方)于一个无菌的50mL离心管。
9)加入至少5倍体积的平衡盐溶液重悬粒细胞,于400×g离心15 min。
10)吸除上清,加入6-8 mL平衡盐缓溶液重悬粒细胞,于室温400-500×g离心10 min。
11)吸除上清,用适当培养液重悬粒细胞备用。
注意事项
1)稀释去纤维蛋白血液或肝素化血液用的盐溶液为无菌液体。
2)为保持淋巴细胞的活性,应该采血后尽快进行分离。分离细胞层实际上是单个核细胞层,包括淋巴细胞和单核细胞。
3)为了您的安全和健康,请穿实验服并戴一次性手套操作;
4)本产品仅作科研用途!
HB211105

暂无内容
[1] Lin S, Zhang A, Yuan L, et al. Targeting parvalbumin promotes M2 macrophage polarization and energy expenditure in mice. Nat Commun. 2022;13(1):3301. Published 2022 Jun 8. doi:10.1038/s41467-022-30757-y(IF:14.919)
