Hieff Trans 线性化聚乙烯亚胺(PEI)转染试剂
产品说明书
FAQ
COA
已发表文献
Hieff Trans® PEI转染试剂是一种经过优化改造后的线性化聚乙烯亚胺(Polyethylenimine Linear, PEI),浓度为1 mg/mL。本产品纯化学合成,不含动物源成分,特别适合多质粒的共同转染,用于重组病毒载体的生产,以及重组蛋白的瞬时表达生产。本产品细胞毒性低、转染效率高、兼容抗生素,在HEK293等细胞中基因表达效率较高。
运输与保存方法
运输方式:冰袋运输。
保存方式:2-8ºC保存,有效期2年。
注意事项
1)为提高转染效率,建议悬浮细胞在无血清培养体系中驯化几天后进行转染操作。
2)转染过程中推荐使用高质量的质粒,如不含内毒素的质粒。
3)为了您的安全和健康,请穿实验服并戴一次性手套及通风橱操作。
4)本产品仅用于科研用途。
转染操作流程
一 悬浮细胞(以1 L体系为例)
1 接种细胞
根据细胞状态,选择合适的接种密度,建议细胞接种密度为1-1.5×106 cells/mL,使第二天转染时细胞密度为2-3×106 cells/mL为宜。
2 转染复合物配置
1)质粒与试剂比例:建议质粒(μg)与试剂(μL)参考配比区间为1:1 – 1:3。
2)质粒稀释:使用50 mL无血清培养基(Opti-MEM)稀释2 mg质粒,并轻轻混匀。
3)试剂稀释:使用48 mL无血清培养基(Opti-MEM)稀释2 mL Hieff Trans® PEI转染试剂,并轻轻混匀。
4)配置复合物:将配置好的50 mL试剂稀释液加入到50 mL质粒稀释液中,轻轻涡旋混匀后,室温静置10–20 min,形成质粒–PEI复合物,备用。
3 转染细胞
1)直接将100 mL的质粒-PEI复合物加入1 L培养的细胞中。
2)在合适温度与CO2等条件下继续培养细胞,并在培养72 h-96 h或摸索的合适条件下进行病毒收获。
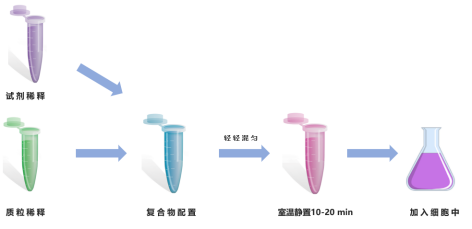
图1 Hieff Trans® PEI转染试剂操作步骤示意图
二 贴壁细胞(以10 cm培养皿为例)
1 接种细胞
根据细胞状态,选择合适的接种密度,建议细胞铺板密度为50–80 %,使第二天转染时细胞密度70–90 %为宜。
2 转染复合物配置
1)质粒与试剂比例:建议质粒(μg)与试剂(μL)参考配比区间为1:1至1:3。
2)质粒稀释:使用250 μL无血清培养基(Opti-MEM)稀释8 μg质粒,并轻轻混匀。
3)试剂稀释:使用242 μL无血清培养基(Opti-MEM)稀释8 μL Hieff Trans® PEI转染试剂,并轻轻混匀。
4)配置复合物:将配置好的250 μL试剂稀释液加入到250 μL质粒稀释液中,轻轻涡旋混匀后,室温静置10–20 min,形成质粒–PEI复合物,备用。
3 转染细胞
1)直接将500 μL的质粒-PEI复合物加入10 mL培养的细胞中。
2)在合适温度与CO2等条件下继续培养细胞,并在培养72 h-96 h或摸索的合适条件下进行病毒收获。
表1 不同细胞培养容器转染用量(仅供参考)
|
培养容器 |
表面积(cm2) |
DNA稀释 |
转染试剂稀释 |
培养基 总量 |
||
|
DNA量(μg) |
稀释液体积(μL) |
转染试剂量(μL) |
稀释液体积(μL) |
|||
|
96孔板 |
0.3 |
0.1 |
5 |
0.1 |
5 |
100 μL |
|
48孔板 |
0.7 |
0.2 |
10 |
0.2 |
10 |
200 μL |
|
24孔板 |
1.9 |
0.5 |
25 |
0.5 |
25 |
500 μL |
|
12孔板 |
3.8 |
1 |
25 |
1 |
25 |
1 mL |
|
6孔板 |
10 |
2 |
50 |
2 |
50 |
2 mL |
|
25 cm2培养瓶 |
21 |
4 |
100 |
4 |
100 |
4 mL |
|
75 cm2培养瓶 |
58 |
8 |
250 |
8 |
250 |
10 mL |
|
10 cm培养皿 |
60 |
8 |
250 |
8 |
250 |
10 mL |
HB220930
Hieff Trans® PEI转染试剂是一种经过优化改造后的线性化聚乙烯亚胺(Polyethylenimine Linear, PEI),浓度为1 mg/mL。本产品纯化学合成,不含动物源成分,特别适合多质粒的共同转染,用于重组病毒载体的生产,以及重组蛋白的瞬时表达生产。本产品细胞毒性低、转染效率高、兼容抗生素,在HEK293等细胞中基因表达效率较高。
运输与保存方法
运输方式:冰袋运输。
保存方式:2-8ºC保存,有效期2年。
注意事项
1)为提高转染效率,建议悬浮细胞在无血清培养体系中驯化几天后进行转染操作。
2)转染过程中推荐使用高质量的质粒,如不含内毒素的质粒。
3)为了您的安全和健康,请穿实验服并戴一次性手套及通风橱操作。
4)本产品仅用于科研用途。
转染操作流程
一 悬浮细胞(以1 L体系为例)
1 接种细胞
根据细胞状态,选择合适的接种密度,建议细胞接种密度为1-1.5×106 cells/mL,使第二天转染时细胞密度为2-3×106 cells/mL为宜。
2 转染复合物配置
1)质粒与试剂比例:建议质粒(μg)与试剂(μL)参考配比区间为1:1 – 1:3。
2)质粒稀释:使用50 mL无血清培养基(Opti-MEM)稀释2 mg质粒,并轻轻混匀。
3)试剂稀释:使用48 mL无血清培养基(Opti-MEM)稀释2 mL Hieff Trans® PEI转染试剂,并轻轻混匀。
4)配置复合物:将配置好的50 mL试剂稀释液加入到50 mL质粒稀释液中,轻轻涡旋混匀后,室温静置10–20 min,形成质粒–PEI复合物,备用。
3 转染细胞
1)直接将100 mL的质粒-PEI复合物加入1 L培养的细胞中。
2)在合适温度与CO2等条件下继续培养细胞,并在培养72 h-96 h或摸索的合适条件下进行病毒收获。
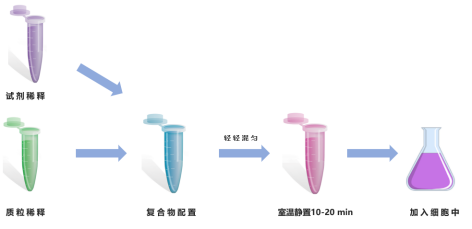
图1 Hieff Trans® PEI转染试剂操作步骤示意图
二 贴壁细胞(以10 cm培养皿为例)
1 接种细胞
根据细胞状态,选择合适的接种密度,建议细胞铺板密度为50–80 %,使第二天转染时细胞密度70–90 %为宜。
2 转染复合物配置
1)质粒与试剂比例:建议质粒(μg)与试剂(μL)参考配比区间为1:1至1:3。
2)质粒稀释:使用250 μL无血清培养基(Opti-MEM)稀释8 μg质粒,并轻轻混匀。
3)试剂稀释:使用242 μL无血清培养基(Opti-MEM)稀释8 μL Hieff Trans® PEI转染试剂,并轻轻混匀。
4)配置复合物:将配置好的250 μL试剂稀释液加入到250 μL质粒稀释液中,轻轻涡旋混匀后,室温静置10–20 min,形成质粒–PEI复合物,备用。
3 转染细胞
1)直接将500 μL的质粒-PEI复合物加入10 mL培养的细胞中。
2)在合适温度与CO2等条件下继续培养细胞,并在培养72 h-96 h或摸索的合适条件下进行病毒收获。
表1 不同细胞培养容器转染用量(仅供参考)
|
培养容器 |
表面积(cm2) |
DNA稀释 |
转染试剂稀释 |
培养基 总量 |
||
|
DNA量(μg) |
稀释液体积(μL) |
转染试剂量(μL) |
稀释液体积(μL) |
|||
|
96孔板 |
0.3 |
0.1 |
5 |
0.1 |
5 |
100 μL |
|
48孔板 |
0.7 |
0.2 |
10 |
0.2 |
10 |
200 μL |
|
24孔板 |
1.9 |
0.5 |
25 |
0.5 |
25 |
500 μL |
|
12孔板 |
3.8 |
1 |
25 |
1 |
25 |
1 mL |
|
6孔板 |
10 |
2 |
50 |
2 |
50 |
2 mL |
|
25 cm2培养瓶 |
21 |
4 |
100 |
4 |
100 |
4 mL |
|
75 cm2培养瓶 |
58 |
8 |
250 |
8 |
250 |
10 mL |
|
10 cm培养皿 |
60 |
8 |
250 |
8 |
250 |
10 mL |
HB220930

暂无内容

暂无内容
