NGS文库转换试剂盒|Universal Library Convert Kit
产品说明书
FAQ
COA
已发表文献
该试剂盒可以将Illumina试剂盒构建的双链线性文库转化为兼容华大智造测序平台的环状ssDNA文库。构建的文库可使用BGISEQ-500RS、 MGISEQ-200RS 和 MGISEQ-2000RS 进行测序。
产品组分
|
组分编号与名称 |
13342ES16 |
13342ES96 |
||
|
13342-A |
|
AC-PCR Amplification mix |
400 μL |
2×1200 μL |
|
13342-B |
|
AC-PCR Primer mix |
16 μL |
96 μL |
|
13342-C |
|
App-A Splint Buffer |
240 μL |
2×720 μL |
|
13342-D |
|
Ligase |
80 μL |
480 μL |
|
13342-E |
|
Digestion Buffer |
130 μL |
780 μL |
|
13342-F |
|
Digestion Enzyme |
32 μL |
192 μL |
运输与保存方法
干冰运输。
所有组分-20°C保存,有效期1年。
*当运输条件、储存条件及使用方式都正确时,所有组分在有效期内均能保持完整活性。
注意事项
一、关于操作
1. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
2. 请于使用前将试剂盒各组分置于室温解冻。解冻后上下颠倒数次充分混匀,短暂离心后置于冰上待用。
3. 配制各步骤反应液时推荐使用移液器吹打混匀或轻轻振荡,剧烈振荡可能会造成文库产出下降。
4. 为避免样品交叉污染,推荐使用带滤芯的枪头,吸取不同样品时请更换枪头。
5. 推荐在带热盖的PCR仪中进行各步骤反应,使用前应预热PCR仪至反应温度附近。
6. 定时对各实验区域进行清洁(使用0.5%次氯酸钠或10%漂白剂进行擦拭清理),以保证实验环境的洁净度。
7. 本产品仅作科研用途!
二、样本要求及处理
2.1样本要求
样本为线性dsDNA文库,接头序列符合下列之一:
单index:
5'-AATGATACGGCGACCACCGAGATCTACAC-TCTTTCCCTACACGACGCTCTTCCGATCT-Insert-AGATCGGAAGAGCACACGTCTGAACTCCAGTCAC-[i7]-ATCTCGTATGCCGTCTTCTGCTTG-3'
双index:
5'-AATGATACGGCGACCACCGAGATCTACAC[i5]ACACTCTTTCCCTACACGACGCTCTTCCGATCT-insert-AGATCGGAAGAGCACACGTCTGAACTCCAGTCAC-[i7]-ATCTCGTATGCCGTCTTCTGCTTG-3'
线性dsDNA文库插入片段范围为 100 ~ 500 bp,同时主带集中在±100 bp 以内。
2.2 样本量要求
根据文库总量选择合适的线性dsDNA投入量,详见表1:
表1 线性dsDNA总量与浓度要求
|
线性dsDNA文库投入量(ng) |
线性dsDNA文库总量(ng) |
线性dsDNA文库浓度要求(ng/μl) |
|
10 |
≤25 |
>0.45 |
|
25 |
25<文库总量<50 |
1<文库浓度<2.1 |
|
50 |
>50 |
>2.1 |
2.3 转换PCR
不同线性 dsDNA 文库投入量,所需 PCR 循环也不相同,详见表2:
表2 不同线性dsDNA投入量PCR循环数推荐表
|
线性dsDNA文库投入量(ng) |
推荐PCR循环数 |
|
10 |
8 |
|
25 |
7 |
|
50 |
6 |
2.4 转换文库pooling要求
1. 不推荐在转换PCR前对线性dsDNA进行pooling。
2. 需将接头转换 PCR 产物混合测序,则 Sample Barcode Pooling 应遵循碱基平衡的原则:最佳平衡状态 ATGC 4种碱基的占比应分别为 25% ,若不能达到 25%,则要保证每个 cycle 都存在 ATGC 四种碱基序列,并且最少的碱基不应低于 12.5%,最多的碱基不应高于 62.5%。
3. 不同片段长度的文库不建议 pooling 环化。
4. 若样本所需数据量相同且长度相同,则可以等量混合,每个样本所需的质量按照公式1进行计算:
公式1混合样本中单个样本所需质量的计算
单个样本所需的质量 (ng)=1 pmol Input DNA 对应的质量 (ng)/混合的样本个数 N
5. 混合后接头转换 PCR 产物总量为 1 pmol,总体积最多为 40 μL;若文库不足则用 TE buffer补充至 40 μL
三、关于磁珠纯化(Bead-based Clean Up)
1. 磁珠使用前应先平衡至室温,否则会导致纯化得率下降。
2. 磁珠每次使用前都应充分振荡混匀或使用移液器上下吹打充分混匀。
3. 磁珠漂洗使用的80%乙醇应现用现配,否则将影响回收效率。
4. 产物洗脱前应将磁珠置于室温干燥。干燥不充分容易造成无水乙醇残留影响后续反应;过分干燥又会导致磁珠开裂进而降低纯化得率。通常情况下,室温干燥约5 min。
5. 单链环产物纯化保存,可使用TE Buffer洗脱,产物可于-20°C可保存1个月。
四、关于文库质检(Library Quality Analysis)
1. 转换文库推荐使用 Qubit® dsDNA HS Assay Kit 或 Quant-iTTM PicoGreen® dsDNA Assay Kit 等双链 DNA 进行定量, 要求最终接头转换 PCR产物的摩尔产量至少为 1 pmol,可根据公式2计算或参考表2。
公式2 PCR 产物摩尔数与质量间的换算
1 pmol PCR 产物对应的质量 (ng)=DNA 主片段大小 (bp)×0.66
表3 不同片段大小PCR产物1 pmol对应产量
|
PCR产物主片段大小(bp) |
1 pmol对应产量(ng) |
|
300 |
198 |
|
350 |
231 |
|
400 |
264 |
|
450 |
297 |
|
500 |
330 |
2. 单链环产物纯化后推荐使用 Qubit® ssDNA Assay Kit 单链 DNA 荧光染料试剂对纯化后产物进行定量。
3. 单链环状 DNA 产物纯化后产量应达到 60 fmol 以上方足够一次上机测序的量,可根据公式3计算或参考表3 。
公式 3 单链环摩尔数与质量间的换算
60 fmol 单链环对应的质量 (ng)=0.06×DNA 主片段大小 (bp)×0.33
表4 不同PCR产物片段大小对应60 fmol单链环产量
|
PCR产物主片段大小(bp) |
60 fmol对应产量(ng) |
|
300 |
5.94 |
|
350 |
6.93 |
|
400 |
7.92 |
|
450 |
8.91 |
|
500 |
9.90 |
使用方法
一、自备材料
1. 纯化磁珠:Cat#12601,Hieff NGS® DNA Selection Beads或Cat#A63880,AMPure XP Beads或其他等效产品。
2. 文库质控:Cat#12640,dsDNA HS Assay Kit for Qubit®或Cat#12642,1×dsDNA HS Assay kit for Qubit®或其他等效产品。
3. 单链环质控:Cat # Q10212, Thermo fisher Qubit® ssDNA Assay Kit或其他等效产品。
3. 其他材料:无水乙醇、灭菌超纯水、TE Buffer(10 mM Tris-HCl,pH 8.0-8.5+0.1 mM EDTA)、低吸附EP管、PCR管、磁力架、PCR仪等。
二、操作流程
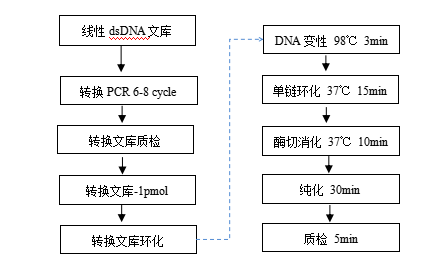
图1 通用文库转换流程
三、操作步骤
Part A接头转换PCR
1.转换PCR
该步骤对线性dsDNA文库进行转换-转化为可以进行后续环化的线性dsDNA文库。
将表5中试剂解冻后颠倒混匀,置于冰上备用。
于无菌PCR管中配制表5所示反应体系。
表5 转换PCR扩增反应体系
|
名称 |
体积(μL) |
|
AC-PCR Amplification Mix |
25 |
|
AC-PCR Primer Mix |
1 |
|
线性dsDNA 文库 |
|
|
ddH2O |
|
|
Total |
50 |
3. 使用移液器轻轻吹打或振荡混匀,并短暂离心将反应液收集至管底。
4. 将PCR管置于PCR仪中,设置表6所示反应程序,进行PCR扩增。
表6 PCR扩增反应程序
|
温度 |
时间 |
循环数 |
|
98°C |
1 min |
1 |
|
98°C |
10 sec |
参照注意事项中表2 |
|
60°C |
30 sec |
|
|
72°C |
30 sec |
|
|
72°C |
5 min |
1 |
|
4°C |
Hold |
– |
2、转换PCR产物纯化
1. 准备工作:将Hieff NGS® DNA Selection Beads磁珠由冰箱中取出,室温平衡至少30 min。配制80%乙醇。
2. 涡旋振荡或充分颠倒磁珠以保证充分混匀。
3. 吸取45 μL Hieff NGS® DNA Selection Beads(0.9×,Beads : DNA=0.9:1)至Adapter Ligation产物中,室温孵育5 min。
4. 将PCR管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约5 min),小心移除上清。
5. 保持PCR管始终置于磁力架中,加入200 μL新鲜配制的80%乙醇漂洗磁珠,室温孵育30 sec后,小心移除上清。
6. 重复步骤5,总计漂洗两次。
7. 保持PCR管始终置于磁力架中,开盖空气干燥磁珠至刚刚出现龟裂(不超过5 min)。
8. 将PCR管从磁力架中取出,进行洗脱:加入32 μL TE buffer,涡旋振荡或使用移液器轻轻吹打至充分混匀,室温静置5 min。
9. 将PCR管短暂离心并置于磁力架中分离磁珠和液体。待溶液澄清后(约5 min),小心转移30 μL上清至干净的管中。
3、转换PCR产物质检
使用 Qubit® dsDNA HS Assay Kit 等转换PCR产物进行定量,具体请参见注意事项四。
Part B 转换文库环化
1 变性
1. 根据文库长度,取1 pmol 至 0.2 ml PCR 管中,用 TE Buffer 补充至总体积 40 μL。
4. 混匀后,在 PCR 仪上进行 98℃变性 3 min,之后立即置于冰上,冰浴 2 min 后瞬时离心。
2 单链环化
1. 将表7中各试剂解冻后,颠倒混匀,置于冰上备用。
2. 于冰上配制表7反应体系。
表7 单链环化体系
|
名称 |
体积(μL) |
|
上一步反应物 |
40 |
|
App-A Splint Buffer |
15 |
|
Ligase |
5 |
|
Total |
60 |
3.使用移液器轻轻吹打或低速振荡混匀,并短暂离心将反应液离心至管底。
4. 将PCR管置于PCR仪上,按照表8所示摄制反应程序,进行单链环化反应。
表8 单链环化反应程序
|
温度 |
时间 |
|
热盖105°C |
OFF |
|
37°C |
15 min |
|
4°C |
Hold |
3 酶切消化
1. 将表9中各试剂解冻后,颠倒混匀,置于冰上备用。
2. 于冰上配制表9所示反应体系。
表9 酶切消化体系
|
名称 |
体积(μL) |
|
上一步反应物 |
60 |
|
Digestion Buffer |
8 |
|
Digestion Enzyme |
2 |
|
Total |
70 |
3. 使用移液器轻轻吹打或低速振荡混匀,并短暂离心将反应液离心至管底。
4. 将PCR管置于PCR仪上,按照表10的条件进行反应:
表10 酶切消化反应程序
|
温度 |
时间 |
|
热盖105°C |
OFF |
|
37°C |
10 min |
|
4°C |
Hold |
5. 反应结束后,瞬时离心,立即进行纯化。
4 消化产物纯化
该步骤使用磁珠对3.3步骤的产物进行纯化。
1. 准备工作:将Hieff NGS® DNA Selection Beads或 Beckman AMPure XP Beads由冰箱中取出,室温平衡至少30 min。配制80%乙醇。
2. 涡旋振荡或充分颠倒磁珠以保证充分混匀。
3. 吸取120 μL Hieff NGS® DNA Selection Beads至消化产物中,室温孵育10min。
4. 将PCR管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约2 min),小心移除上清。
5. 保持PCR管始终置于磁力架中,加入500μL新鲜配制的80%乙醇漂洗磁珠,室温孵育30 sec后,小心移除上清。
6. 重复步骤5,总计漂洗两次。
7. 保持PCR管始终置于磁力架中,开盖空气干燥磁珠至刚刚出现龟裂。
8. 将PCR管从磁力架中取出,加入22 μL TE Buffer,涡旋振荡或使用移液器轻轻吹打至充分混匀,室温静置10 min。
9. 短暂离心,将 PCR 管始终置于磁力架中静置,待溶液澄清后(约 2min),将上清小心移至新 PCR 管中, -20℃保存,待制备 DNB。
5 消化产物质控
使用Qubit® ssDNA Assay Kit荧光试剂对酶切消化产物进行定量,具体请参见注意事项四。
HB220117
该试剂盒可以将Illumina试剂盒构建的双链线性文库转化为兼容华大智造测序平台的环状ssDNA文库。构建的文库可使用BGISEQ-500RS、 MGISEQ-200RS 和 MGISEQ-2000RS 进行测序。
产品组分
|
组分编号与名称 |
13342ES16 |
13342ES96 |
||
|
13342-A |
|
AC-PCR Amplification mix |
400 μL |
2×1200 μL |
|
13342-B |
|
AC-PCR Primer mix |
16 μL |
96 μL |
|
13342-C |
|
App-A Splint Buffer |
240 μL |
2×720 μL |
|
13342-D |
|
Ligase |
80 μL |
480 μL |
|
13342-E |
|
Digestion Buffer |
130 μL |
780 μL |
|
13342-F |
|
Digestion Enzyme |
32 μL |
192 μL |
运输与保存方法
干冰运输。
所有组分-20°C保存,有效期1年。
*当运输条件、储存条件及使用方式都正确时,所有组分在有效期内均能保持完整活性。
注意事项
一、关于操作
1. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
2. 请于使用前将试剂盒各组分置于室温解冻。解冻后上下颠倒数次充分混匀,短暂离心后置于冰上待用。
3. 配制各步骤反应液时推荐使用移液器吹打混匀或轻轻振荡,剧烈振荡可能会造成文库产出下降。
4. 为避免样品交叉污染,推荐使用带滤芯的枪头,吸取不同样品时请更换枪头。
5. 推荐在带热盖的PCR仪中进行各步骤反应,使用前应预热PCR仪至反应温度附近。
6. 定时对各实验区域进行清洁(使用0.5%次氯酸钠或10%漂白剂进行擦拭清理),以保证实验环境的洁净度。
7. 本产品仅作科研用途!
二、样本要求及处理
2.1样本要求
样本为线性dsDNA文库,接头序列符合下列之一:
单index:
5'-AATGATACGGCGACCACCGAGATCTACAC-TCTTTCCCTACACGACGCTCTTCCGATCT-Insert-AGATCGGAAGAGCACACGTCTGAACTCCAGTCAC-[i7]-ATCTCGTATGCCGTCTTCTGCTTG-3'
双index:
5'-AATGATACGGCGACCACCGAGATCTACAC[i5]ACACTCTTTCCCTACACGACGCTCTTCCGATCT-insert-AGATCGGAAGAGCACACGTCTGAACTCCAGTCAC-[i7]-ATCTCGTATGCCGTCTTCTGCTTG-3'
线性dsDNA文库插入片段范围为 100 ~ 500 bp,同时主带集中在±100 bp 以内。
2.2 样本量要求
根据文库总量选择合适的线性dsDNA投入量,详见表1:
表1 线性dsDNA总量与浓度要求
|
线性dsDNA文库投入量(ng) |
线性dsDNA文库总量(ng) |
线性dsDNA文库浓度要求(ng/μl) |
|
10 |
≤25 |
>0.45 |
|
25 |
25<文库总量<50 |
1<文库浓度<2.1 |
|
50 |
>50 |
>2.1 |
2.3 转换PCR
不同线性 dsDNA 文库投入量,所需 PCR 循环也不相同,详见表2:
表2 不同线性dsDNA投入量PCR循环数推荐表
|
线性dsDNA文库投入量(ng) |
推荐PCR循环数 |
|
10 |
8 |
|
25 |
7 |
|
50 |
6 |
2.4 转换文库pooling要求
1. 不推荐在转换PCR前对线性dsDNA进行pooling。
2. 需将接头转换 PCR 产物混合测序,则 Sample Barcode Pooling 应遵循碱基平衡的原则:最佳平衡状态 ATGC 4种碱基的占比应分别为 25% ,若不能达到 25%,则要保证每个 cycle 都存在 ATGC 四种碱基序列,并且最少的碱基不应低于 12.5%,最多的碱基不应高于 62.5%。
3. 不同片段长度的文库不建议 pooling 环化。
4. 若样本所需数据量相同且长度相同,则可以等量混合,每个样本所需的质量按照公式1进行计算:
公式1混合样本中单个样本所需质量的计算
单个样本所需的质量 (ng)=1 pmol Input DNA 对应的质量 (ng)/混合的样本个数 N
5. 混合后接头转换 PCR 产物总量为 1 pmol,总体积最多为 40 μL;若文库不足则用 TE buffer补充至 40 μL
三、关于磁珠纯化(Bead-based Clean Up)
1. 磁珠使用前应先平衡至室温,否则会导致纯化得率下降。
2. 磁珠每次使用前都应充分振荡混匀或使用移液器上下吹打充分混匀。
3. 磁珠漂洗使用的80%乙醇应现用现配,否则将影响回收效率。
4. 产物洗脱前应将磁珠置于室温干燥。干燥不充分容易造成无水乙醇残留影响后续反应;过分干燥又会导致磁珠开裂进而降低纯化得率。通常情况下,室温干燥约5 min。
5. 单链环产物纯化保存,可使用TE Buffer洗脱,产物可于-20°C可保存1个月。
四、关于文库质检(Library Quality Analysis)
1. 转换文库推荐使用 Qubit® dsDNA HS Assay Kit 或 Quant-iTTM PicoGreen® dsDNA Assay Kit 等双链 DNA 进行定量, 要求最终接头转换 PCR产物的摩尔产量至少为 1 pmol,可根据公式2计算或参考表2。
公式2 PCR 产物摩尔数与质量间的换算
1 pmol PCR 产物对应的质量 (ng)=DNA 主片段大小 (bp)×0.66
表3 不同片段大小PCR产物1 pmol对应产量
|
PCR产物主片段大小(bp) |
1 pmol对应产量(ng) |
|
300 |
198 |
|
350 |
231 |
|
400 |
264 |
|
450 |
297 |
|
500 |
330 |
2. 单链环产物纯化后推荐使用 Qubit® ssDNA Assay Kit 单链 DNA 荧光染料试剂对纯化后产物进行定量。
3. 单链环状 DNA 产物纯化后产量应达到 60 fmol 以上方足够一次上机测序的量,可根据公式3计算或参考表3 。
公式 3 单链环摩尔数与质量间的换算
60 fmol 单链环对应的质量 (ng)=0.06×DNA 主片段大小 (bp)×0.33
表4 不同PCR产物片段大小对应60 fmol单链环产量
|
PCR产物主片段大小(bp) |
60 fmol对应产量(ng) |
|
300 |
5.94 |
|
350 |
6.93 |
|
400 |
7.92 |
|
450 |
8.91 |
|
500 |
9.90 |
使用方法
一、自备材料
1. 纯化磁珠:Cat#12601,Hieff NGS® DNA Selection Beads或Cat#A63880,AMPure XP Beads或其他等效产品。
2. 文库质控:Cat#12640,dsDNA HS Assay Kit for Qubit®或Cat#12642,1×dsDNA HS Assay kit for Qubit®或其他等效产品。
3. 单链环质控:Cat # Q10212, Thermo fisher Qubit® ssDNA Assay Kit或其他等效产品。
3. 其他材料:无水乙醇、灭菌超纯水、TE Buffer(10 mM Tris-HCl,pH 8.0-8.5+0.1 mM EDTA)、低吸附EP管、PCR管、磁力架、PCR仪等。
二、操作流程
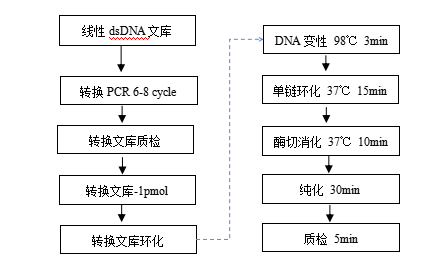
图1 通用文库转换流程
三、操作步骤
Part A接头转换PCR
1.转换PCR
该步骤对线性dsDNA文库进行转换-转化为可以进行后续环化的线性dsDNA文库。
将表5中试剂解冻后颠倒混匀,置于冰上备用。
于无菌PCR管中配制表5所示反应体系。
表5 转换PCR扩增反应体系
|
名称 |
体积(μL) |
|
AC-PCR Amplification Mix |
25 |
|
AC-PCR Primer Mix |
1 |
|
线性dsDNA 文库 |
|
|
ddH2O |
|
|
Total |
50 |
3. 使用移液器轻轻吹打或振荡混匀,并短暂离心将反应液收集至管底。
4. 将PCR管置于PCR仪中,设置表6所示反应程序,进行PCR扩增。
表6 PCR扩增反应程序
|
温度 |
时间 |
循环数 |
|
98°C |
1 min |
1 |
|
98°C |
10 sec |
参照注意事项中表2 |
|
60°C |
30 sec |
|
|
72°C |
30 sec |
|
|
72°C |
5 min |
1 |
|
4°C |
Hold |
– |
2、转换PCR产物纯化
1. 准备工作:将Hieff NGS® DNA Selection Beads磁珠由冰箱中取出,室温平衡至少30 min。配制80%乙醇。
2. 涡旋振荡或充分颠倒磁珠以保证充分混匀。
3. 吸取45 μL Hieff NGS® DNA Selection Beads(0.9×,Beads : DNA=0.9:1)至Adapter Ligation产物中,室温孵育5 min。
4. 将PCR管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约5 min),小心移除上清。
5. 保持PCR管始终置于磁力架中,加入200 μL新鲜配制的80%乙醇漂洗磁珠,室温孵育30 sec后,小心移除上清。
6. 重复步骤5,总计漂洗两次。
7. 保持PCR管始终置于磁力架中,开盖空气干燥磁珠至刚刚出现龟裂(不超过5 min)。
8. 将PCR管从磁力架中取出,进行洗脱:加入32 μL TE buffer,涡旋振荡或使用移液器轻轻吹打至充分混匀,室温静置5 min。
9. 将PCR管短暂离心并置于磁力架中分离磁珠和液体。待溶液澄清后(约5 min),小心转移30 μL上清至干净的管中。
3、转换PCR产物质检
使用 Qubit® dsDNA HS Assay Kit 等转换PCR产物进行定量,具体请参见注意事项四。
Part B 转换文库环化
1 变性
1. 根据文库长度,取1 pmol 至 0.2 ml PCR 管中,用 TE Buffer 补充至总体积 40 μL。
4. 混匀后,在 PCR 仪上进行 98℃变性 3 min,之后立即置于冰上,冰浴 2 min 后瞬时离心。
2 单链环化
1. 将表7中各试剂解冻后,颠倒混匀,置于冰上备用。
2. 于冰上配制表7反应体系。
表7 单链环化体系
|
名称 |
体积(μL) |
|
上一步反应物 |
40 |
|
App-A Splint Buffer |
15 |
|
Ligase |
5 |
|
Total |
60 |
3.使用移液器轻轻吹打或低速振荡混匀,并短暂离心将反应液离心至管底。
4. 将PCR管置于PCR仪上,按照表8所示摄制反应程序,进行单链环化反应。
表8 单链环化反应程序
|
温度 |
时间 |
|
热盖105°C |
OFF |
|
37°C |
15 min |
|
4°C |
Hold |
3 酶切消化
1. 将表9中各试剂解冻后,颠倒混匀,置于冰上备用。
2. 于冰上配制表9所示反应体系。
表9 酶切消化体系
|
名称 |
体积(μL) |
|
上一步反应物 |
60 |
|
Digestion Buffer |
8 |
|
Digestion Enzyme |
2 |
|
Total |
70 |
3. 使用移液器轻轻吹打或低速振荡混匀,并短暂离心将反应液离心至管底。
4. 将PCR管置于PCR仪上,按照表10的条件进行反应:
表10 酶切消化反应程序
|
温度 |
时间 |
|
热盖105°C |
OFF |
|
37°C |
10 min |
|
4°C |
Hold |
5. 反应结束后,瞬时离心,立即进行纯化。
4 消化产物纯化
该步骤使用磁珠对3.3步骤的产物进行纯化。
1. 准备工作:将Hieff NGS® DNA Selection Beads或 Beckman AMPure XP Beads由冰箱中取出,室温平衡至少30 min。配制80%乙醇。
2. 涡旋振荡或充分颠倒磁珠以保证充分混匀。
3. 吸取120 μL Hieff NGS® DNA Selection Beads至消化产物中,室温孵育10min。
4. 将PCR管短暂离心并置于磁力架中分离磁珠和液体,待溶液澄清后(约2 min),小心移除上清。
5. 保持PCR管始终置于磁力架中,加入500μL新鲜配制的80%乙醇漂洗磁珠,室温孵育30 sec后,小心移除上清。
6. 重复步骤5,总计漂洗两次。
7. 保持PCR管始终置于磁力架中,开盖空气干燥磁珠至刚刚出现龟裂。
8. 将PCR管从磁力架中取出,加入22 μL TE Buffer,涡旋振荡或使用移液器轻轻吹打至充分混匀,室温静置10 min。
9. 短暂离心,将 PCR 管始终置于磁力架中静置,待溶液澄清后(约 2min),将上清小心移至新 PCR 管中, -20℃保存,待制备 DNB。
5 消化产物质控
使用Qubit® ssDNA Assay Kit荧光试剂对酶切消化产物进行定量,具体请参见注意事项四。
HB220117

暂无内容

暂无内容






