CHO细胞残留DNA检测试剂盒|CHO Host Cell DNA Residue Detection Kit
产品说明书
FAQ
COA
已发表文献
CHO宿主细胞DNA残留检测试剂盒是用于定量分析检测各种生物制品的中间品、半成品和成品中的CHO残留DNA含量的试剂盒。
本试剂盒采用探针法荧光定量PCR原理,可专一快速的检测CHO细胞的残留DNA,其最低检测限可以达到fg水平。该试剂盒可与本公司的磁珠法残留DNA样本前处理试剂盒(Cat#18461ES/18462ES)配套使用。
产品组分
|
组分编号 |
组分名称 |
产品编号/规格 |
|
|
41301ES50(50T) |
41301ES60(100T) |
||
|
41301-A |
CHO qPCR mix |
1 mL |
2 mL |
|
41301-B |
DNA Dilution Buffer |
2×2 mL |
4×2 mL |
|
41301-C |
CHO DNA Control(30 ng/μL) |
25 μL |
50 μL |
【注】:本试剂盒不含ROX参比染料,若您目前使用的Real Time PCR扩增仪需要添加ROX参比染料,推荐您购买本公司的50× ROX Reference Dye(Cat#10200ES)。
运输和保存方法
1.所有组分均干冰运输,-20℃保存,有效期2年。
2. 收到货后,请检查共3个组分是否齐全,并立即放入对应的保存温度中储存。
注意事项
1. 使用本试剂前请仔细阅读本说明书,实验应规范操作,包括样本处理、反应体系的配制及加样。
2. 加样和配液步骤尽量都在冰上操作。
3. 每个组分在使用前都应充分震荡混匀,低速离心。
4. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
5. 本产品仅作科研用途。
适用机型
包含但不限于以下仪器:
Bio-Rad:CFX96 Optic Module;
Thermo Scientific:ABI 7500;ABI Quant Studio 5;ABI Step OnePlus.
使用方法
一、CHO DNA定量参考品的稀释和标准曲线的制备
用试剂盒中提供的DNA稀释液将DNA定量参考品进行梯度稀释,稀释浓度依次为300 pg/μL、30 pg/μL、3 pg/μL、300 fg/μL、30 fg/μL、3 fg/μL。
具体操作如下:
1. 将试剂盒中的DNA 定量参考品和DNA稀释液置于冰上融化,待完全融化后,轻微振荡混匀,低速离心10 sec。
2. 取7支洁净的1.5 mL离心管,分别标记为 3 ng/μL,①,②,③,④,⑤,⑥。
3. 在标记为3 ng/μL的1.5mL离心管中加入90 μL DNA 稀释液和10 μL DNA 定量参考品(30 ng/μL),即稀释为3 ng/μL,振荡混匀后短时间快速离心10 sec,该浓度可分装置于-20℃短期保存(不超过3个月),使用时避免反复冻融。
4. 在 ①,②,③,④,⑤,⑥ 管中先分别加入90 μL DNA稀释液,再进行梯度稀释,稀释方法如下:
|
稀释管 |
稀释比例 |
终浓度 |
|
① |
10 μL 3 ng/μL+90 μL DNA 稀释液 |
300 pg/μL |
|
② |
10 μL ①+90 μL DNA 稀释液 |
30 pg/μL |
|
③ |
10 μL ②+90 μL DNA 稀释液 |
3 pg/μL |
|
④ |
10 μL ③+90 μL DNA 稀释液 |
300 fg/μL |
|
⑤ |
10 μL ④+90 μL DNA 稀释液 |
30 fg/μL |
|
⑥ |
10 μL ⑤+90 μL DNA 稀释液 |
3 fg/μL |
【注】:
1. 每个浓度做3个复孔,该试剂可测试3 fg/μL-300 pg/μL线性范围。若需要,可适当扩大或缩小线性范围。
2. 为减少反复冻融次数和避免污染,建议初次使用时将DNA定量参考品分装储存于-20℃。
3. 已融化未使用的 DNA 稀释液可保存于2-8 ℃ 7天,若长时间不用,请放置于-20℃。
4. 为确保模板完全混匀,每个梯度稀释时需轻微震荡混匀约1 min。
二、样本加标回收质控QC的制备
根据需要设QC中的CHO DNA标准品浓度(以制备加3 pg/μL DNA量的样本加标回收为例),具体操作如下:
- 取100 μL待测样本加入1.5 mL洁净的离心管中,再加入10μL 溶液③,混匀,标记为加标回收QC。
- 加标回收QC和同批待测样本一起进行样本前处理,制备加标回收QC纯化液。
三、标准品回收质控QC的制备(可选)
根据需要设QC中的CHO DNA标准品浓度(以制备加3 pg/μL DNA量的标准品回收为例),具体操作如下:
- 取100 μL 溶液③加入1.5 mL洁净的离心管中,标记为标准品回收QC。
- 标准品回收QC和同批待测样本一起进行样本前处理,制备标准品回收QC纯化液。
四、阴性质控NCS的制备
根据实验设置阴性质控,具体操作如下:
- 取100 μL样本基质溶液(或DNA 稀释液)加入1.5 mL洁净的离心管中,标记为阴性质控NCS。
- 阴性质控NCS和同批待测样本一起进行样本前处理,制备成阴性质控NCS纯化液。
五、无模板对照NTC的制备
根据实验设置无模板对照NTC,具体操作如下:
- 无模板对照NTC无需进行样本前处理,在qPCR法检测残留DNA含量阶段开始配置即可。
- 每管或孔中的NTC样本为20 μL CHO qPCR Mix + 20 μL DNA Dilution Buffer,建议配置3个重复孔的量。
六、反应体系
|
组分 |
体积(μL) |
|
CHO qPCR Mix |
20 |
|
DNA template |
20 |
|
总体积 |
40 |
【注】:
1. 根据反应孔数计算本次所需的qPCR Mix总量:qPCR Mix =(反应孔数+2)×20 μL(含有2孔的损失量)。通常,每个样本做3个重复孔。
2. 加样完成密封好管子后,请先低速离心10 sec将管壁的液体离心收集至管底,再震荡混匀5 sec以上,完全混匀反应液,再低速离心10 sec将管壁的液体离心收集至管底,如有气泡,需将气泡排尽。
下图为参考板位:
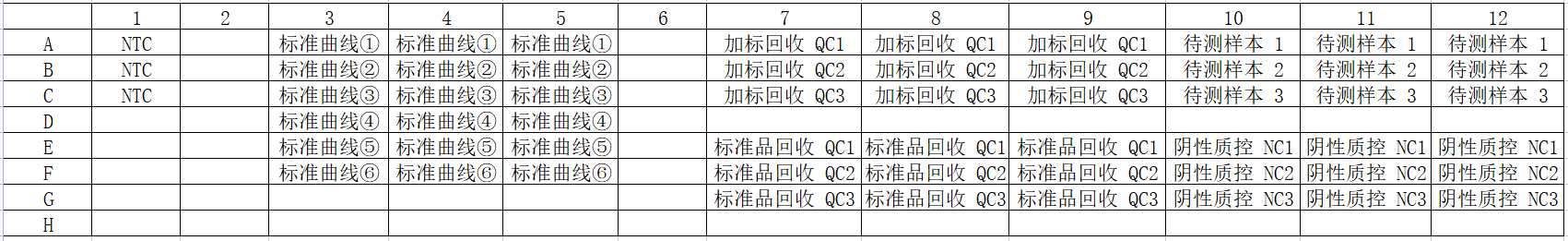
该示例是对CHO残留DNA qPCR法检测操作的展示,检测样本包括:1个无模板对照NTC、6个浓度梯度的DNA标准曲线、3个样本加标回收QC、3个待测样本、3个标准品回收QC(可选)、3个阴性质控NCS(1个即可)。建议每个样本做3个重复孔。
七、扩增程序参数设置(两步法)(以Bio-Rad公司CFX 96 qPCR仪、软件版本4.1.2433.1219为例)
- 创建空白新程序,选择绝对定量检测模板。
- 创建1个检测探针,命名为“CHO-DNA”,选择“run setup”栏中的“select run type”下方的“user-define”,在“run setup”界面中开始程序、板位、通道的设置:
2.1 首先,在“protocol”下点击“Create New”开始设置PCR程序,设置好后点击“OK”,保存程序文件。
2.2 点击“Next”或者“plate”进入孔位设置界面,点击“create new”,在“Scan Mode”中可以选择“All Channels”或者“SYBR/FAM Only”选项。用鼠标勾选反应格,点击“select fluorophores”选项,勾选“FAM”后点击“OK”,在“sample type”选项下选择“unknow”(或其他样本类型),勾选“target name栏下的“load”右边的框,同时根据个人需求设置“target name”,也可不设置。根据个人需求在选项“Sample names”和“Biological Group”中输入样本名称和组别,也可不设置。点击“OK”保存好最后的结果文件。
2.3 点击“Next”或“Start run”,开始仪器运行。
- 扩增程序设置:设置反应体积40 μL。
|
循环步骤 |
温度(℃) |
时间 |
循环数 |
|
预变性 |
95 ℃ |
5 min |
1 |
|
变性 |
95 ℃ |
15 sec |
40 |
|
退火/延伸(收集荧光) |
60 ℃ |
30 sec |
八、qPCR 结果分析
- 上机结束后,在程序的右上角点击“plate setup” 栏下的“view/edit plate”,选中标准品的反应格,在右侧的“sample type”栏下选择“standard”,设置好每个梯度的重复孔,在“loda concentration”下输入所做的浓度后按“enter”键确认,依次将标准品的梯度设置完成。
- 点击“OK”,返回到初始界面,即可读取标准曲线的R²、扩增效率(Eff%)、斜率(Slope)、截距(Intercept)等。正常的标曲:R²>0.99;扩增效率在90%≤Eff%≤110%范围内;Slope在–3.4左右。
- 根据设置的样本名称和组别,读取无模板对照NTC、阴性质控NCS、待测样本和样本加标回收等的检测值,单位为fg/μL,后续可在检测报告中将单位换算成pg/μL或pg/mL。
HB221226
CHO宿主细胞DNA残留检测试剂盒是用于定量分析检测各种生物制品的中间品、半成品和成品中的CHO残留DNA含量的试剂盒。
本试剂盒采用探针法荧光定量PCR原理,可专一快速的检测CHO细胞的残留DNA,其最低检测限可以达到fg水平。该试剂盒可与本公司的磁珠法残留DNA样本前处理试剂盒(Cat#18461ES/18462ES)配套使用。
产品组分
|
组分编号 |
组分名称 |
产品编号/规格 |
|
|
41301ES50(50T) |
41301ES60(100T) |
||
|
41301-A |
CHO qPCR mix |
1 mL |
2 mL |
|
41301-B |
DNA Dilution Buffer |
2×2 mL |
4×2 mL |
|
41301-C |
CHO DNA Control(30 ng/μL) |
25 μL |
50 μL |
【注】:本试剂盒不含ROX参比染料,若您目前使用的Real Time PCR扩增仪需要添加ROX参比染料,推荐您购买本公司的50× ROX Reference Dye(Cat#10200ES)。
运输和保存方法
1.所有组分均干冰运输,-20℃保存,有效期2年。
2. 收到货后,请检查共3个组分是否齐全,并立即放入对应的保存温度中储存。
注意事项
1. 使用本试剂前请仔细阅读本说明书,实验应规范操作,包括样本处理、反应体系的配制及加样。
2. 加样和配液步骤尽量都在冰上操作。
3. 每个组分在使用前都应充分震荡混匀,低速离心。
4. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
5. 本产品仅作科研用途。
适用机型
包含但不限于以下仪器:
Bio-Rad:CFX96 Optic Module;
Thermo Scientific:ABI 7500;ABI Quant Studio 5;ABI Step OnePlus.
使用方法
一、CHO DNA定量参考品的稀释和标准曲线的制备
用试剂盒中提供的DNA稀释液将DNA定量参考品进行梯度稀释,稀释浓度依次为300 pg/μL、30 pg/μL、3 pg/μL、300 fg/μL、30 fg/μL、3 fg/μL。
具体操作如下:
1. 将试剂盒中的DNA 定量参考品和DNA稀释液置于冰上融化,待完全融化后,轻微振荡混匀,低速离心10 sec。
2. 取7支洁净的1.5 mL离心管,分别标记为 3 ng/μL,①,②,③,④,⑤,⑥。
3. 在标记为3 ng/μL的1.5mL离心管中加入90 μL DNA 稀释液和10 μL DNA 定量参考品(30 ng/μL),即稀释为3 ng/μL,振荡混匀后短时间快速离心10 sec,该浓度可分装置于-20℃短期保存(不超过3个月),使用时避免反复冻融。
4. 在 ①,②,③,④,⑤,⑥ 管中先分别加入90 μL DNA稀释液,再进行梯度稀释,稀释方法如下:
|
稀释管 |
稀释比例 |
终浓度 |
|
① |
10 μL 3 ng/μL+90 μL DNA 稀释液 |
300 pg/μL |
|
② |
10 μL ①+90 μL DNA 稀释液 |
30 pg/μL |
|
③ |
10 μL ②+90 μL DNA 稀释液 |
3 pg/μL |
|
④ |
10 μL ③+90 μL DNA 稀释液 |
300 fg/μL |
|
⑤ |
10 μL ④+90 μL DNA 稀释液 |
30 fg/μL |
|
⑥ |
10 μL ⑤+90 μL DNA 稀释液 |
3 fg/μL |
【注】:
1. 每个浓度做3个复孔,该试剂可测试3 fg/μL-300 pg/μL线性范围。若需要,可适当扩大或缩小线性范围。
2. 为减少反复冻融次数和避免污染,建议初次使用时将DNA定量参考品分装储存于-20℃。
3. 已融化未使用的 DNA 稀释液可保存于2-8 ℃ 7天,若长时间不用,请放置于-20℃。
4. 为确保模板完全混匀,每个梯度稀释时需轻微震荡混匀约1 min。
二、样本加标回收质控QC的制备
根据需要设QC中的CHO DNA标准品浓度(以制备加3 pg/μL DNA量的样本加标回收为例),具体操作如下:
- 取100 μL待测样本加入1.5 mL洁净的离心管中,再加入10μL 溶液③,混匀,标记为加标回收QC。
- 加标回收QC和同批待测样本一起进行样本前处理,制备加标回收QC纯化液。
三、标准品回收质控QC的制备(可选)
根据需要设QC中的CHO DNA标准品浓度(以制备加3 pg/μL DNA量的标准品回收为例),具体操作如下:
- 取100 μL 溶液③加入1.5 mL洁净的离心管中,标记为标准品回收QC。
- 标准品回收QC和同批待测样本一起进行样本前处理,制备标准品回收QC纯化液。
四、阴性质控NCS的制备
根据实验设置阴性质控,具体操作如下:
- 取100 μL样本基质溶液(或DNA 稀释液)加入1.5 mL洁净的离心管中,标记为阴性质控NCS。
- 阴性质控NCS和同批待测样本一起进行样本前处理,制备成阴性质控NCS纯化液。
五、无模板对照NTC的制备
根据实验设置无模板对照NTC,具体操作如下:
- 无模板对照NTC无需进行样本前处理,在qPCR法检测残留DNA含量阶段开始配置即可。
- 每管或孔中的NTC样本为20 μL CHO qPCR Mix + 20 μL DNA Dilution Buffer,建议配置3个重复孔的量。
六、反应体系
|
组分 |
体积(μL) |
|
CHO qPCR Mix |
20 |
|
DNA template |
20 |
|
总体积 |
40 |
【注】:
1. 根据反应孔数计算本次所需的qPCR Mix总量:qPCR Mix =(反应孔数+2)×20 μL(含有2孔的损失量)。通常,每个样本做3个重复孔。
2. 加样完成密封好管子后,请先低速离心10 sec将管壁的液体离心收集至管底,再震荡混匀5 sec以上,完全混匀反应液,再低速离心10 sec将管壁的液体离心收集至管底,如有气泡,需将气泡排尽。
下图为参考板位:
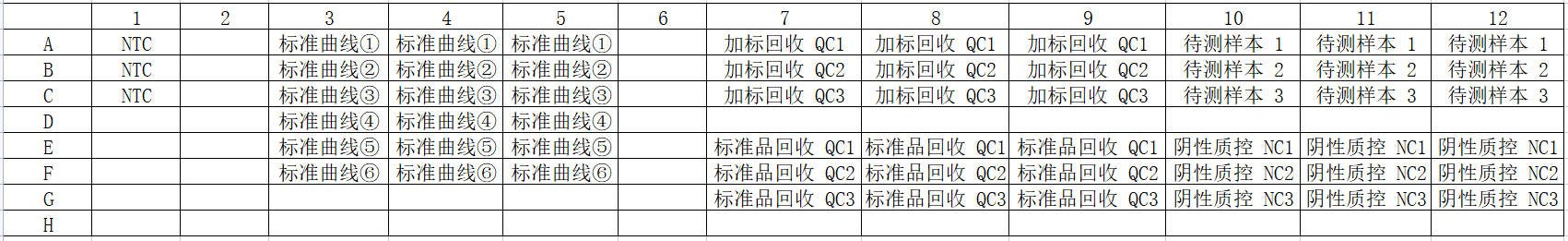
该示例是对CHO残留DNA qPCR法检测操作的展示,检测样本包括:1个无模板对照NTC、6个浓度梯度的DNA标准曲线、3个样本加标回收QC、3个待测样本、3个标准品回收QC(可选)、3个阴性质控NCS(1个即可)。建议每个样本做3个重复孔。
七、扩增程序参数设置(两步法)(以Bio-Rad公司CFX 96 qPCR仪、软件版本4.1.2433.1219为例)
- 创建空白新程序,选择绝对定量检测模板。
- 创建1个检测探针,命名为“CHO-DNA”,选择“run setup”栏中的“select run type”下方的“user-define”,在“run setup”界面中开始程序、板位、通道的设置:
2.1 首先,在“protocol”下点击“Create New”开始设置PCR程序,设置好后点击“OK”,保存程序文件。
2.2 点击“Next”或者“plate”进入孔位设置界面,点击“create new”,在“Scan Mode”中可以选择“All Channels”或者“SYBR/FAM Only”选项。用鼠标勾选反应格,点击“select fluorophores”选项,勾选“FAM”后点击“OK”,在“sample type”选项下选择“unknow”(或其他样本类型),勾选“target name栏下的“load”右边的框,同时根据个人需求设置“target name”,也可不设置。根据个人需求在选项“Sample names”和“Biological Group”中输入样本名称和组别,也可不设置。点击“OK”保存好最后的结果文件。
2.3 点击“Next”或“Start run”,开始仪器运行。
- 扩增程序设置:设置反应体积40 μL。
|
循环步骤 |
温度(℃) |
时间 |
循环数 |
|
预变性 |
95 ℃ |
5 min |
1 |
|
变性 |
95 ℃ |
15 sec |
40 |
|
退火/延伸(收集荧光) |
60 ℃ |
30 sec |
八、qPCR 结果分析
- 上机结束后,在程序的右上角点击“plate setup” 栏下的“view/edit plate”,选中标准品的反应格,在右侧的“sample type”栏下选择“standard”,设置好每个梯度的重复孔,在“loda concentration”下输入所做的浓度后按“enter”键确认,依次将标准品的梯度设置完成。
- 点击“OK”,返回到初始界面,即可读取标准曲线的R²、扩增效率(Eff%)、斜率(Slope)、截距(Intercept)等。正常的标曲:R²>0.99;扩增效率在90%≤Eff%≤110%范围内;Slope在–3.4左右。
- 根据设置的样本名称和组别,读取无模板对照NTC、阴性质控NCS、待测样本和样本加标回收等的检测值,单位为fg/μL,后续可在检测报告中将单位换算成pg/μL或pg/mL。
HB221226
Q:我们CHO标准品用的是哪里的?
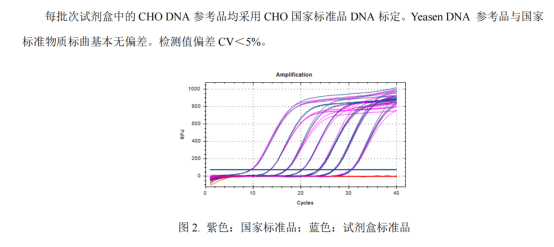
A:是我们内部自己抽提的CHO细胞的基因组DNA,每批次参考品采用中检院的国家标准品标定,结果如下:
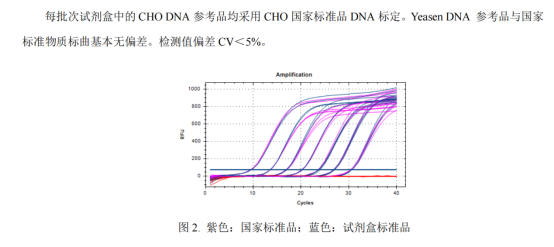
翌圣E.coli的试剂盒的标准品分别从E.coli菌株中抽提的基因组DNA,有完整的溯源;抽提之后我们会用Qubit进行浓度检测;再根据这个浓度进行标准品的稀释,后续会用qPCR的方法与中检院购买的国家DNA进行标定,Yeasen DNA参考品与国家标准物质(同样会用Qubit的检测方法进行浓度复核)标曲基本无偏差(老师这边可以看一下下图我们做的对比结果)。
Q:细胞残留DNA的前提取有配套的机型么?如果用湖州申科的适配么?
A:我们目前有手动提取和自动提取两个版本,其中自动提取可以适配奥盛 Auto-Pure32A 全自动核酸提取仪及同类型仪器,后期也可以根据客户需要进行调整。我们的前处理试剂盒,可以适配我司的所有残留DNA检测试剂盒,申科的试剂盒原则上应该都可以适配。

暂无内容