潮霉素B Hygromycin B(50 mg/mL PBS缓冲液) 氨基糖苷类抗生素|CAS 31282-04-9
产品说明书
FAQ
COA
已发表文献
潮霉素B(Hygromycin B)是由吸水链霉菌(Streptomyces hygroscopicus)代谢产生的一种氨基糖苷类抗生素,通过干扰70S核糖体易位和诱导对mRNA模板的错读而抑制蛋白合成,从而杀死原核(如细菌)、真核(如酵母菌,真菌)和高等哺乳动物真核细胞。
大肠杆菌( Escherichia coli.)来源的潮霉素抗性基因(hyg或hph),编码潮霉素B磷酸转移酶,将潮霉素B转化成不具有生物活性的磷酸化产物,从而起到解毒作用。针对这一原理,潮霉素B是一种非常有用的选择性标记,用来筛选和维持培养成功转染潮霉素抗性基因的原核或者真核细胞。另外,由于作用模式的差异,常与G418 (GeneticinTM),Zeocin™ 和Blasticidin S联合使用进行双抗性阳性细胞株的选择。潮霉素B还能用作抗病毒剂,因其选择性渗透进入因病毒感染增强通透性的细胞,且具有抑制翻译的功效。还可混合入动物饲料中起到驱虫功能。
本品是无菌的潮霉素B溶液(50 mg/mL in PBS buffer),可直接用培养液稀释使用。
产品信息
|
货号 |
60224JP03 / 60224JP10 |
|
规格 |
1 g (20 mL) / 10×1g(20mL) |
|
CAS号(CAS NO.) |
31282-04-9 |
|
分子式(Molecular Fomular) |
C20H37N3O13 |
|
分子量(Molecular Weight) |
527.52 g/mol |
|
外观(Appearance) |
液体 |
|
纯度(Purity) |
>90% by HPLC |
|
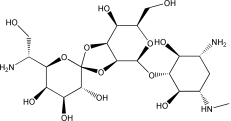
结构(Structure) |
|
组分信息
|
组分名称 |
60224JP03 |
60224JP10 |
|
规格 |
1 g (20 mL) |
10×1g (20mL) |
储存条件
2~8℃保存,避免反复冻融。有效期2年。
使用说明
1. 常用筛选浓度
潮霉素B用来筛选稳转株的工作浓度需要根据细胞类型、培养基、生长条件和细胞代谢率而变化,推荐使用浓度为50-1000 μg/mL。对于第一次使用的实验体系建议建立杀灭曲线(kill curve),即剂量反应性曲线,来确定最佳筛选浓度。
一般而言,哺乳动物细胞50-500 μg/mL;细菌/植物细胞20-200 μg/mL;真菌300-1000 μg/mL。
2. 杀灭曲线的建立
为了筛选得到稳定表达目的蛋白的细胞株,需要确定能够杀死未转染宿主细胞的抗生素最低浓度,可通过建立杀灭曲线(剂量反应曲线)来实现,至少选择5个浓度。
1)第一天:未转化的细胞按照20-25%的细胞密度铺在合适的培养板上,37℃,CO2培养过夜。【注】:对于需要更高密度来检测活力的细胞,可增加接种量。
2)根据细胞类型,设定合适范围内的浓度梯度。以哺乳动物细胞为例,可设定50,100,250,500,750,1000 μg/mL。先用去离子水或者PBS buffer按照1:10的比例将母液稀释到5 mg/mL,然后按照下表稀释到相应浓度的工作液。
|
终浓度(μg/mL) |
培养基体积(mL) |
5 mg/mL潮霉素B加入体积(mL) |
|
50 |
9.9 |
0.1 |
|
100 |
9.8 |
0.2 |
|
250 |
9.5 |
0.5 |
|
500 |
9.0 |
1.0 |
|
750 |
8.5 |
1.5 |
|
1000 |
8.0 |
2.0b |
3)第二天:替换旧的培养基,换用新鲜配制的含有相应浓度药物的培养基。每个浓度做三个平行孔。
4)接下来每3-4天更换新的含药物培养基。
5)按照固定的周期(如每2天)进行活细胞计数来确定阻止未转染细胞生长的恰当浓度。选择在理想的天数(通常是7-10天)内能够杀死绝大多数细胞的最低浓度为稳定转染细胞筛选用的工作浓度。
3. 稳定转染细胞的筛选
1)转染48 h后,用含有适当浓度的潮霉素B筛选培养基来传代细胞(直接传代或者稀释后传代)。【注】:细胞处于活跃分裂状态时抗生素的杀伤效果最好。则当细胞过于稠密,其效率会降低。为了得到较好的筛选效果,最好将细胞稀释至丰度不超过25%。
2)每隔3-4天更换含有药物的筛选培养液。
3)筛选7天后观察并评估细胞克隆(集落)的形成情况。集落的形成可能还需要一周或者更多的时间,这取决于宿主细胞类型,转染,以及筛选效果。
4)挑取并转移5-10个抗性克隆于35 mm细胞培养板,继续用含药物的筛选培养液维持培养7天。
5)之后更换正常培养基培养即可。
注意事项
1. 潮霉素B的抗性基因(hyg或hph)除了来自E. Coli.外,还发现于其他的菌株,包括Streptomyces hygroscopicus和Klebsiella pneumoniae。
2. 本品为有毒化合物,避免与皮肤和眼睛接触,请小心操作。
3. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
4. 本产品仅用于科研用途,禁止用于人身上。
潮霉素B(Hygromycin B)是由吸水链霉菌(Streptomyces hygroscopicus)代谢产生的一种氨基糖苷类抗生素,通过干扰70S核糖体易位和诱导对mRNA模板的错读而抑制蛋白合成,从而杀死原核(如细菌)、真核(如酵母菌,真菌)和高等哺乳动物真核细胞。
大肠杆菌( Escherichia coli.)来源的潮霉素抗性基因(hyg或hph),编码潮霉素B磷酸转移酶,将潮霉素B转化成不具有生物活性的磷酸化产物,从而起到解毒作用。针对这一原理,潮霉素B是一种非常有用的选择性标记,用来筛选和维持培养成功转染潮霉素抗性基因的原核或者真核细胞。另外,由于作用模式的差异,常与G418 (GeneticinTM),Zeocin™ 和Blasticidin S联合使用进行双抗性阳性细胞株的选择。潮霉素B还能用作抗病毒剂,因其选择性渗透进入因病毒感染增强通透性的细胞,且具有抑制翻译的功效。还可混合入动物饲料中起到驱虫功能。
本品是无菌的潮霉素B溶液(50 mg/mL in PBS buffer),可直接用培养液稀释使用。
产品信息
|
货号 |
60224JP03 / 60224JP10 |
|
规格 |
1 g (20 mL) / 10×1g(20mL) |
|
CAS号(CAS NO.) |
31282-04-9 |
|
分子式(Molecular Fomular) |
C20H37N3O13 |
|
分子量(Molecular Weight) |
527.52 g/mol |
|
外观(Appearance) |
液体 |
|
纯度(Purity) |
>90% by HPLC |
|
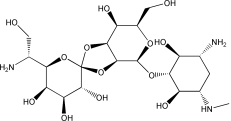
结构(Structure) |
|
组分信息
|
组分名称 |
60224JP03 |
60224JP10 |
|
规格 |
1 g (20 mL) |
10×1g (20mL) |
储存条件
2~8℃保存,避免反复冻融。有效期2年。
使用说明
1. 常用筛选浓度
潮霉素B用来筛选稳转株的工作浓度需要根据细胞类型、培养基、生长条件和细胞代谢率而变化,推荐使用浓度为50-1000 μg/mL。对于第一次使用的实验体系建议建立杀灭曲线(kill curve),即剂量反应性曲线,来确定最佳筛选浓度。
一般而言,哺乳动物细胞50-500 μg/mL;细菌/植物细胞20-200 μg/mL;真菌300-1000 μg/mL。
2. 杀灭曲线的建立
为了筛选得到稳定表达目的蛋白的细胞株,需要确定能够杀死未转染宿主细胞的抗生素最低浓度,可通过建立杀灭曲线(剂量反应曲线)来实现,至少选择5个浓度。
1)第一天:未转化的细胞按照20-25%的细胞密度铺在合适的培养板上,37℃,CO2培养过夜。【注】:对于需要更高密度来检测活力的细胞,可增加接种量。
2)根据细胞类型,设定合适范围内的浓度梯度。以哺乳动物细胞为例,可设定50,100,250,500,750,1000 μg/mL。先用去离子水或者PBS buffer按照1:10的比例将母液稀释到5 mg/mL,然后按照下表稀释到相应浓度的工作液。
|
终浓度(μg/mL) |
培养基体积(mL) |
5 mg/mL潮霉素B加入体积(mL) |
|
50 |
9.9 |
0.1 |
|
100 |
9.8 |
0.2 |
|
250 |
9.5 |
0.5 |
|
500 |
9.0 |
1.0 |
|
750 |
8.5 |
1.5 |
|
1000 |
8.0 |
2.0b |
3)第二天:替换旧的培养基,换用新鲜配制的含有相应浓度药物的培养基。每个浓度做三个平行孔。
4)接下来每3-4天更换新的含药物培养基。
5)按照固定的周期(如每2天)进行活细胞计数来确定阻止未转染细胞生长的恰当浓度。选择在理想的天数(通常是7-10天)内能够杀死绝大多数细胞的最低浓度为稳定转染细胞筛选用的工作浓度。
3. 稳定转染细胞的筛选
1)转染48 h后,用含有适当浓度的潮霉素B筛选培养基来传代细胞(直接传代或者稀释后传代)。【注】:细胞处于活跃分裂状态时抗生素的杀伤效果最好。则当细胞过于稠密,其效率会降低。为了得到较好的筛选效果,最好将细胞稀释至丰度不超过25%。
2)每隔3-4天更换含有药物的筛选培养液。
3)筛选7天后观察并评估细胞克隆(集落)的形成情况。集落的形成可能还需要一周或者更多的时间,这取决于宿主细胞类型,转染,以及筛选效果。
4)挑取并转移5-10个抗性克隆于35 mm细胞培养板,继续用含药物的筛选培养液维持培养7天。
5)之后更换正常培养基培养即可。
注意事项
1. 潮霉素B的抗性基因(hyg或hph)除了来自E. Coli.外,还发现于其他的菌株,包括Streptomyces hygroscopicus和Klebsiella pneumoniae。
2. 本品为有毒化合物,避免与皮肤和眼睛接触,请小心操作。
3. 为了您的安全和健康,请穿实验服并戴一次性手套操作。
4. 本产品仅用于科研用途,禁止用于人身上。

暂无内容
[1] Wu LY, Shang GD, Wang FX, et al. Dynamic chromatin state profiling reveals regulatory roles of auxin and cytokinin in shoot regeneration. Dev Cell. 2022;57(4):526-542.e7. doi:10.1016/j.devcel.2021.12.019(IF:12.270)
[2] Zhang TQ, Chen Y, Wang JW. A single-cell analysis of the Arabidopsis vegetative shoot apex. Dev Cell. 2021;56(7):1056-1074.e8. doi:10.1016/j.devcel.2021.02.021(IF:12.270)
[3] Wang FX, Shang GD, Wu LY, Xu ZG, Zhao XY, Wang JW. Chromatin Accessibility Dynamics and a Hierarchical Transcriptional Regulatory Network Structure for Plant Somatic Embryogenesis. Dev Cell. 2020;54(6):742-757.e8. doi:10.1016/j.devcel.2020.07.003(IF:10.092)
[4] Zhou C, Zeng Z, Suo J, et al. Manipulating a Single Transcription Factor, Ant1, Promotes Anthocyanin Accumulation in Barley Grains. J Agric Food Chem. 2021;69(18):5306-5317. doi:10.1021/acs.jafc.0c08147(IF:5.279)
[5] Huang H, Zhong L, Zhou J, et al. Leydig-like cells derived from reprogrammed human foreskin fibroblasts by CRISPR/dCas9 increase the level of serum testosterone in castrated male rats. J Cell Mol Med. 2020;24(7):3971-3981. doi:10.1111/jcmm.15018(IF:4.486)